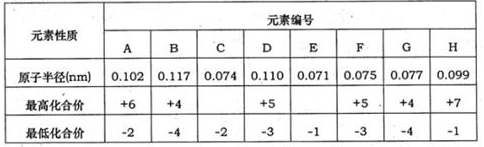
下表为部分短周期元素化合价及其相应原子半径的数据。请回答下列问题:
(1)元素G在周期中的位置是 ;元素F所形成的常见单质的电子式为 。
(2)A、B、C、E的氢化物稳定性顺序是 。(用化学式回答)
(3)分子组成为ACH2的物质在水中会强烈水解,产生使品红溶液褪色的无色气体和一种强酸。该反应的化学方程式是 。
(4)请写出B的单质的一种重要用途 ;工业上制取该单质的原理反应为 。
(5)请设计一个实验方案,使铜和A的最高价氧化物对应的水化物的稀溶液反应,得到蓝色溶液和氢气。请在方框内绘出该实验方案原理装置示意图。

(11分)(1)第二周期第ⅣA族;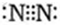 (各1分) (2)HF>H2O>H2S>SiH4(2分)
(各1分) (2)HF>H2O>H2S>SiH4(2分)
(3)SOCl2+H2O=2HC+SO2↑(2分)
(4)半导体材料、制造合金、光电池等合理答案(1分);SiO2+2C Si+2CO↑(2分)
Si+2CO↑(2分)
(5)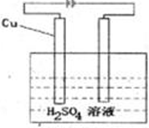 (2分)
(2分)
题目分析:根据元素的主要化合价和原子半径的递变规律可知,元素A~H分别是S、Si、O、P、F、N、C、Cl。
(1)元素G是C元素,在周期中的位置是第二周期第ⅣA族;元素F所形成的常见单质是氮气,其电子式为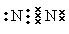 。
。
(2)非金属性越强,氢化物的稳定性越强。同周期自左向右非金属性逐渐增强,同主族自上而下非金属性逐渐减弱, A、B、C、E的非金属性强弱顺序是F>O>S>Si,所以其氢化物稳定性顺序是HF>H2O>H2S>SiH4。
(3)分子组成为ACH2的物质是SOCl2,在水中会强烈水解,产生使品红溶液褪色的无色气体和一种强酸,所以该气体是SO2。根据原子守恒可知,强酸应该是盐酸,所以该反应的化学方程式是SOCl2+H2O=2HC+SO2↑。
(4)硅单质的一种重要用途半导体材料、制造合金、光电池等;工业上制取该单质的原理反应为SiO2+2C Si+2CO↑。
Si+2CO↑。
(5)铜不能和稀硫酸反应生成氢气和硫酸铜,因此要使该反应进行,则应该借助于电解原理。其中铜和电源的正极相连,作阳极,电解质溶液是稀硫酸。氢离子在阴极放电生成氢气,所以该装置图是 。
。
