问题
计算题
利用中和反应可以测定酸或碱溶液中溶质的质量分数。下图为某次测定过程中,溶液的pH随所滴加的某标准溶液体积的变化而变化的关系图。
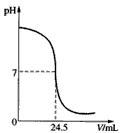
(1)根据上图曲线可以判断实验中是向________(填“酸”或“碱”, 下同)溶液(待测液)中滴加_______溶液(标准液)。
(2)在这次测定中,为了指示中和反应刚好完全,用酚酞作指示剂, 即在待测溶液中先滴入几滴酚酞试液。若测定中看到___________,则证明中和反应正好完成。
(3)如果实验中使用的酸是硫酸,碱是氢氧化钠,且待测液和标准液的密度均以1.0g/mL计。若测定中取用待测液25 mL,标准液溶质的质量分数为4.5%,根据图中数据,计算待测液溶质的质量分数。
答案
(1)碱;酸
(2)碱溶液的红色刚好褪去
(3)消耗掉的H2SO4质量:24.5 mL×1.0g/mL=24.5 g
消耗掉的H2SO4溶液中溶质的质量:24.5 g × 4.5% =1.10 g
解:设待测液溶质的质量分数为x
由2NaOH+H2SO4 == Na2SO4+2H2O 得
x=0.036(即3.6%)
答:待测液溶质的质量分数为3.6%。