我国柴达木盆地拥有丰富的盐矿资源,液体矿床以钾矿为主,伴生着镁、溴等多种矿产。工业上取盐湖苦卤的浓缩液(富含K+、Mg2+、Br-、SO42-、Cl-等),来制取较纯净的氯化钾晶体及液溴(Br2),工业流程如下
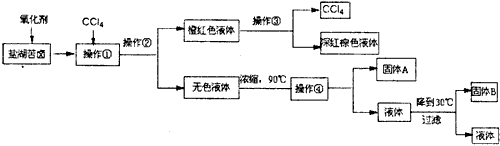
请根据以上流程,回答相关问题:
(1)操作①需要的玻璃仪器有__________________。
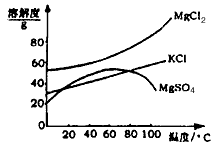
(2)参照下图溶解度曲线,有人认为固体B是氯化钾,有人说是氯化镁,请说出你的观点和支撑你观点的理由:____________________________
(3)同学甲模仿实验室中粗盐提纯的操作,对上述操作②后无色液体设计了除杂提纯实验方案,也可制得较纯净的氯化钾晶体。其方案流程如下
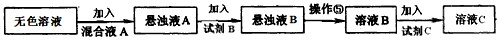
有关资料:
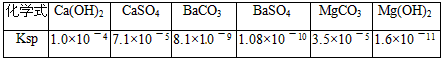
(i)该方案中的无色溶液就是操作②后无色液体,混合液A的主要成分是___________。(填化学式)有人认为用一种试剂__________________(填化学式)就可以起到混合液A的作用,你的观点是____________________________________。
(ii)有同学提出从经济上考虑可以用石灰乳代替试剂A进行实验,经讨论,其他同学一致认为该提议不可行,他们的理由是______________________。
(ⅲ)实验过程中,若要确保Mg2+完全除尽,用广泛pH试纸测定溶液的pH应≥__________。(若离子浓度小于10-5mol·L-1可视作已被完全除尽)。
(ⅳ)对溶液B加热并不断滴加l mol·L-1的盐酸溶液,同时用pH试纸检测溶液,直至pH=5时停止加盐酸,得到溶液C。由溶液C得到固体C的操作名称是__________________。
(ⅴ)工业流程中也可以获得氯化镁的溶液,从中可以提取金属材料镁。
方法是:加热蒸发氯化镁的溶液得到MgCl2·6H2O,在_______中加热使其失去结晶水得到MgCl2,电解就可以得到金属镁。
(1)分液漏斗
(2)固体B是氯化钾,操作④析出硫酸镁固体后的滤液中Mg2+的浓度较小
(3)(ⅰ)BaCl2和KOH;Ba(OH)2;用混合液好,因溶液中的Mg2+和SO42-的物质的量之比不一定是1:1,可控制所加两种试剂的量把杂质离子刚好除去,而用Ba(OH)2可能会浪费试剂。
(ⅱ)CaSO4的Ksp比BaSO4大得多,使用石灰乳难以使溶液中的SO42-沉淀完全
(ⅲ)12
(ⅳ)蒸发结晶
(ⅴ)HCl气流中
