已知A~O分别代表一种物质,它们之间的转化关系如下图所示(反应条件略去)。A、B、H分别是由短周期元素组成的单质。B与冷水缓慢反应,与沸水迅速反应,放出氢气。D是一种离子化合物,其阴阳离子的个数比为2:3,且能与水反应得到两种碱。C为淡黄色固体化合物,O能与G的水溶液反应生成蓝色沉淀。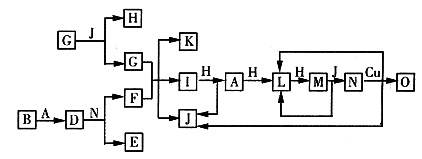
请回答下列问题:
(1)组成B单质的元素位于周期表()周期,第()族。化合物C的电子式为()。
(2)J的沸点比硒化氢(H2Se)的沸点高,其原因是()。
(3)写出I与H在点燃条件下反应生成A和J的化学方程式:()。
(4)写出D与足量的N反应生成E和F的化学方程式:()。
(5)上图中,在同一反应里一种物质既作氧化剂,又作还原剂,这样的反应共有()个。
参考答案:
(1)三 ⅡA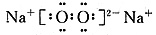
(2)水分子之间存在氢键且比硒化氢的分子间作用力强
(3)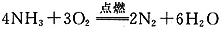
(4)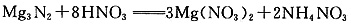
(5)2
解析:
本题以框图推断题的形式综合考查元素化合物知识。解答本题的关键是利用框图所示转化关系和题中信息确定A、B、C、D等分别代表的物质。
由题中关于B的叙述可推出B为金属镁;D为氮化镁,则A为氮气;利用物质C的色态和转化可知C是Na2O2,结合图示转化关系推知J为H2O,则单质H为O2,G为NaOH;再利用A→L→M→N→O可知A、L、M、N、O分别为N2、NO、NO2、HNO3、Cu(NO3)2。从而逆推知)为NH3,再利用
 可知F为NH4NO3,E为Mg(NO3)2,K为NaNO3。
可知F为NH4NO3,E为Mg(NO3)2,K为NaNO3。
(1)Mg位于第三周期、ⅡA族;Na2O2的电子式为:
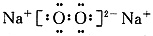 。
。
(2)H2O的沸点比H2Se的高,原因是水分子之间存在氢键,且比H2Se分子间的作用力强。
(5)在上述转化关系中,只有Na2O2+H2O的反应和NO2+H2O的反应中,Na2O2与NO2两物质既作氧化剂,又作还原剂,故这类反应只有2个。
