含A元素的一种单质是一种重要的半导体材料,含A元素的一种化合物C可用于制造高性能的现代通讯材料——光导纤维,C与烧碱反应生成含A元素的化合物D。
(1)在元素周期表中,A位于 族,与A同族但相对原子质量比A小的元素B的原子结构示意图为 ,A与B在原子的电子层结构上的相同点是 。
(2)易与C发生化学反应的酸是 ,反应的化学方程式是 。
(3)将C与纯碱混合高温熔融时也发生化学反应生成D,同时还生成B的最高价氧化物E;将全部的E与全部的D在足量的水中混合后,又发生化学反应生成含A的化合物F。
①写出生成D和F的化学反应方程式: 。
②要将纯碱高温熔化,下列坩埚中可选用的是 。
A.普通玻璃坩埚 B.石英玻璃坩埚
C.氧化铝坩锅 D.铁坩锅
(4)100 g C与石灰石的混合物充分反应后,生成的气体在标准状况下的体积为11.2 L,100 g混合物中石灰石的质量分数是 。
(1)ⅣA 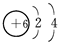 最外层均有4个电子,最内层均有2个电子
最外层均有4个电子,最内层均有2个电子
(2)氢氟酸 SiO2+4HF=SiF4↑+2H2O
(3)①SiO2+Na2CO3 Na2SiO3+CO2↑,
Na2SiO3+CO2↑,
Na2SiO3+CO2+H2O=Na2CO3+H2SiO3↓
②D (4)50%
(1)A元素单质可作半导体材料,含A元素的某化合物是制造光导纤维的原料,可知A为硅元素,C为SiO2,D为Na2SiO3。比硅相对原子质量小的同族元素B为碳。
(2)C为SiO2,能与SiO2反应的酸只有氢氟酸。
(3)SiO2与Na2CO3高温下反应生成Na2SiO3和CO2,含SiO2的材料(普通玻璃、石英玻璃)以及Al2O3等都能与Na2CO3在高温下反应,故不能用以上材质的坩埚熔融Na2CO3。
(4)若SiO2恰好完全反应或过量,与CaCO3反应的化学方程式只有一个,即CaCO3+SiO2 CaSiO3+CO2↑。若CaCO3过量,除发生上述反应外,还会发生反应:
CaSiO3+CO2↑。若CaCO3过量,除发生上述反应外,还会发生反应:
CaCO3 CaO+CO2↑。总之,CaCO3的多少决定了CO2的产量,可通过以下关系列式求解:
CaO+CO2↑。总之,CaCO3的多少决定了CO2的产量,可通过以下关系列式求解:
CaCO3 ~ CO2
100 g 22.4 L
m(CaCO3) 11.2 L
m(CaCO3)=50 g
混合物中CaCO3的质量分数: ×100%=50%。
×100%=50%。
