随着能源问题的进一步突出,利用热化学循环制氢的研究受到许多发达国家的青睐.最近的研究发现,复合氧化物酸锰(MnFe2O4)也可用于热化学循环分解水制氢,MnFe2O4的制备流程如下:
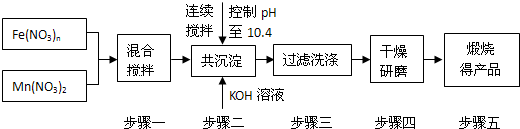
(1)原料Fe(NO3)n中n=______,投入原料Fe(NO3)n和Mn(NO3)2的物质的量之比应为______.
(2)步骤二中“连续搅拌”的目的是______;步骤三中洗涤干净的标准是______.
(3)利用MnFe2O4热化学循环制氢的反应可表示为:MnFe2O4
MnFe2O4-x+>1000K
O2↑ MnFe2O4-x+xH2O→MnFe2O4+xH2↑x 2
请认真分析上述两个反应并回答下列问题:
①若MnFe2O4-x中X=0.8,则MnFe2O4-x中Fe2+占全部铁元素的百分率为______.
②该热化学循环制氢的优点有(答两点即可)______.
(1)Mn为+2价,令MnFe2O4中Fe的化合价为a价,根据化合价代数和为0,则2+2a+4×(-2)=0,解得a=+3,则Fe(NO3)n中n=3.
由MnFe2O4组成可知:Fe和Mn的个数之比为1:2,根据质量守恒可知,Fe(NO3)n与Mn(NO3)2 二者之比 2:1.
故答案为:3;2:1;
(2)连续搅拌是为了让二者充分反应.沉淀可能附着KOH等,洗涤至中性,说明洗涤干净,保证产物纯净.
故答案为:充分反应或沉淀完全;洗涤至流出液呈中性.
(3)①x=0.8时,铁的总价态为(4-0.8)×2-2=4.4,设1mol MnFe2O4-0.8中含Fe2+、Fe3+物质的量分别为xmol、ymol,则有x+y=2,2x+3y=4.4,联立解得:x=1.6,y=0.4,
则1mol MnFe2O4-0.8中含Fe2+的物质的量为1.6mol,则Fe2+占的百分率为
×100%=80%.1.6mol 2mol
故答案为:80%;
②由流程图可以看出过程简单、节约能量、无污染、物料廉价并可循环使用及氧气和氢气在不同步骤生成,不存在高温气体分离的问题等.
故答案为:过程简单、节约能量、无污染、物料廉价并可循环使用及氧气和氢气在不同步骤生成,不存在高温气体分离的问题等.
