(1)如图1,A、B、C三个实验用于验证质量守恒定律:
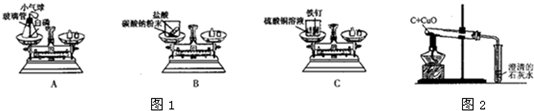
①实验C中,烧杯中看到的现象是______;
②其中不能达到实验目的是______,理由是______.
(2)如图2是“用木碳还原氧化铜”的演示实验,请回答下列问题:
①写出用木碳还原氧化铜的化学方程式:______;
②反应进行一段时间后,为了探究试管中剩余固体的组成,待试管冷却到室温后,取剩余固体于烧杯中,再加入过量稀硫酸,充分搅拌后过滤.
a.若滤纸上留有黑色、红色固体,而滤液为无色,则滤液中的溶质是______,说明试管中的剩余固体为______;
b.若滤纸上留有黑色、红色固体,而滤液呈蓝色,此时滤液中的溶质是______.
(3)如图是探究酸碱中和的实验:
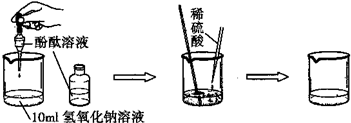
小丽同学为探究上述反应后烧杯中的硫酸是否过量,选取BaCl2、锌粒、紫色石蕊等三种药品和试剂来设计实验,请你根据下表判断出正确的实验方案及分析错误方案的出错原因:
| 实验方案 | 实验步骤 | 实验现象 | 实验结论 |
| 方案一 | 取样,滴入适量的氯化钡溶液 | 出现白色沉淀 | 硫酸过量 |
| 方案二 | 取样,放入几粒锌粒 | 溶液中产生气泡 | 硫酸过量 |
| 方案三 | 取样,滴入几滴紫色石蕊溶液 | 溶液变红 | 硫酸过量 |
②请分析错误方案的原因:______.
(1)①铁能置换出硫酸铜中的铜,因此实验C中,烧杯中看到的现象是铁钉表面变成红色;
故答案为:铁钉表面变成红色;
②用图A中的装置进行验证质量守恒定律,能达到目的,原因在于装置是密封的;
图B不能达到目的,因为生成的二氧化碳气体逸散到空气中去了;
图C也能达到目的,因为生成物和反应物中都没有气体产生;
故答案为:B; 生成的二氧化碳气体逸散到空气中去了;
(2)①木炭与氧化铜在高温下反应生成铜和二氧化碳,化学方程式为:C+2CuO
2Cu+CO2↑; 高温 .
②a、铜、碳和稀硫酸不反应,氧化铜与稀硫酸反应,滤纸上留有黑色、红色固体,滤液为无色,说明剩余固体中没有氧化铜,黑色固体一定是木炭,加入稀硫酸没有参加反应,故滤液中溶质为硫酸,试管中的剩余固体为木炭.
b、若滤纸上有黑色、红色固体,而滤液呈蓝色,说明氧化铜与木炭都剩余,此时滤液中的溶质一定含有硫酸与氧化铜反应生成的硫酸铜,而硫酸是过量的,所以溶质还有硫酸.
故答案为:①C+2CuO
2Cu+CO2↑;②a、H2SO4;木炭、Cu;b、CuSO4、H2SO4; 高温 .
(3)因为方案一即使硫酸不过量,氢氧化钠和硫酸生成的硫酸钠也与氯化钡反应生成硫酸钡沉淀,而活泼金属锌能与酸反应生成氢气、石蕊试液遇酸变红色,所以方案二、三正确;
故答案为:①方案二和方案三;②溶液中有生成的硫酸钠,加入氯化钡溶液即使硫酸不过量同样产生白色沉淀.
