将一定量的丙醇(C3H8O)和氧气置于一个密闭容器中引燃,测得反应前后各物质的质量如下表:
| 物质 | 丙醇 | 氧气 | 水 | 二氧化碳 | X |
| 反应前质量/g | 6.0 | 12.8 | 0 | 0 | 0 |
| 反应后质量/g | 0 | 0 | 7.2 | 8.8 | a |
A.表中a的值为0
B.X可能含有氢元素
C.丙醇发生的是分解反应
D.增加氧气的质量,X质量会减少
A、根据质量守恒定律,反应前后质量相等,故6.0g+12.8g=7.2g+8.8g+a,则a=2.8g,即a的值为2.8,故A不正确;
B、根据质量守恒定律,化学反应前后各元素的质量不变:可求6.0克丙醇(C3H8O)中氢元素的质量为:6.0g×
×100%=0.8克,水中氢元素的质量为:7.2g×1×8 12×3+1×8+16
×100%=0.8克,二者所含氢元素的质量相等,则说明X中一定不含有氢元素;故B不正确;1×2 18
C、根据表中信息可以知道丙醇和氧气为反应,而水、二氧化碳和X为生成物,该反应不属于分解反应的特点,故C不正确;
D、氧气充足的情况下,含碳物质能够发生完全燃烧而生成二氧化碳,故D正确.
故选D.

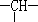 和一个-Cl,它可能的结构有__________种.(本题不考虑对映异构体)
和一个-Cl,它可能的结构有__________种.(本题不考虑对映异构体)