硝酸跟金属反应时,随着硝酸浓度的下降和金属活动性的增大,产物中氮元素的化合价会逐渐下降,它们可能是NO2、NO、N2O、N2或NH4NO3中的一种或几种.现有一定量的铁粉和铝粉组成的混合物跟100mL稀硝酸充分反应,反应过程中无任何气体放出,往反应后的澄清溶液中逐渐加入4.00mol•L-1的NaOH溶液,加入NaOH溶液的体积与产生沉淀的质量的关系如图所示(必要时可加热,忽略气体在水中的溶解):
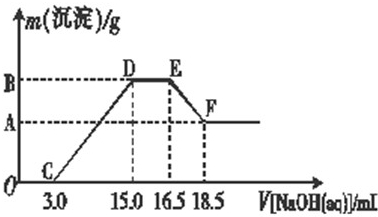
请回答下列问题:
(1)由图可知,往反应后的澄清溶液中加入NaOH溶液没有立即出现沉淀,其原因是______.
(2)混合物跟稀硝酸充分反应后的产物中铁元素的化合价是______.
(3)写出图中D-→E阶段所发生的反应的离子方程式:______.
(4)纵坐标中A点的数值是______,原稀硝酸的浓度是______.
根据图象可知:混合溶液中含有的溶质有Fe(NO3)3、Al(NO3)3、NH4NO3、HNO3
(1)由O点到C点,氢氧化钠溶液恰好和HNO3生成NaNO3;故答案为:硝酸过量,氢氧化钠先中和过量的硝酸;
(2)图象分析,铁粉和铝粉组成的混合物跟100mL稀硝酸充分反应,硝酸剩余,铁被硝酸氧化为三价铁;故答案为:+3;
(3)由D点到E点,氢氧化钠溶液恰好和NH4NO3反应生成硝酸钠、一水合氨;离子方程式为:NH4++OH-=NH3↑+H2O;故答案为:NH4++OH-=NH3↑+H2O;
(4)由C与D点,氢氧化钠溶液恰好和Fe(NO3)3、Al(NO3)3反应生成NaNO3;
由D点到E点,氢氧化钠溶液恰好和NH4NO3反应生成硝酸钠、一水合氨通过上面的分析、根据氮原子守恒可知O点到D点硝酸钠的物质的量=硝酸的物质的量,从D点到E点硝酸的物质=2硝酸钠的物质的量,而硝酸钠的物质的量=氢氧化钠的物质的量,所以硝酸的物质的量=4mol/L×0.015L+2×4mol/L×(0.0165L-0.015L)=0.072mol,
所以原硝酸的物质的量浓度=
=0.72mol/L0.072mol 0.1L
根据EF可知:沉淀减少,说明氢氧化铝溶解,所以氢氧化铝的物质的量=EF线段加入氢氧化钠溶液的物质的量
即:n[Al(OH)3]=4mol/L×(0.0185L-0.0165L)=0.008mol,
根据题意可知:生成0.008mol氢氧化铝沉淀消耗氢氧化钠的物质的量=3×0.008mol=0.024mol
CD段生成沉淀为氢氧化铝和氢氧化铁,
所以生成氢氧化铁消耗氢氧化钠的物质的量=4mol/L×(0.015L-0.003L)-0.024mol=0.024mol
n[Fe(OH)3]=
=1 3n(NaOH)
=0.008mol1 3×0.024mol
纵坐标A点的数值即是生成氢氧化铁的质量=0.008mol×107g/mol=0.856g;
故答案为:0.856g;0.72mol/L;
