如图为铜片与浓硝酸反应的装置示意图,据图回答下列问题:
(1)写出试管内发生反应的化学方程式______;
(2)描述在实验过程中观察到的颜色变化:
试管内液体呈______色;试管内液体上方气体呈______色;集气瓶内收集到的气体呈______色.
(3)在反应一段时间后,从分液漏斗处向试管内加入蒸馏水,请描述加水后试管内和集气瓶内颜色的变化情况:试管内液体呈______色;试管内液体上方气体呈______色.
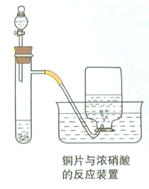
(1)硝酸具强氧化性,能把不活泼的金属铜氧化成铜离子,同时被还原成二氧化氮.
故答案为:Cu+4HNO3 (浓)=Cu(NO3)2+2NO2↑+2H2O.
(2)试管内的溶液是硝酸铜溶液,铜与浓硝酸反应后溶液颜色呈现绿色.原因是产生的红棕色二氧化氮气体一部分溶解在溶液中呈黄色,而溶液中[Cu(H2O)4]2+呈蓝色,两者的混合色为绿色;
试管内液体上方的气体是二氧化氮,二氧化氮呈红棕色,所以试管内液体上方的气体呈红棕色;
二氧化氮气体和水反应生成无色气体NO,3NO2+H2O=2HNO3+NO,所以集气瓶内收集到的气体呈无色.
故答案为:绿;红棕;无.
(3)从分液漏斗处向试管内加入蒸馏水,二氧化氮气体和水反应,溶液呈现铜离子的颜色,所以试管内液体是蓝色;
3NO2+H2O=2HNO3+NO,NO是无色的,所以试管内液体上方气体呈无(或红棕色变浅)色.
故答案为:蓝;无(或红棕色变浅).
