硝酸工业在国民经济、国防工业和航天事业中占有重要地位.随着化学纤维、近代有机合成、火箭、导弹等工业的迅速发展,需要使用大量的硝酸.
(1)工业生产中用铂系金属作为催化剂,用氨氧化法制取硝酸.写出用铂铑合金作催化剂由氨氧化制备硝酸的第一步反应的化学方程式______.浓硝酸和浓硫酸的混合酸是有机合成中常用的硝化剂,写出将苯滴入浓硝酸和浓硫酸混合液中,并在50℃--60℃反应的化学方程式______.
(2)铜既能与稀硝酸反应,也能与浓硝酸反应,当铜与一定浓度硝酸反应时,可将方程式表示为:Cu+HNO3→Cu(NO3)2+NO↑+NO2↑+H2O (方程式未配平).则硝酸在该反应中的作用是______.如果得到的NO和NO2物质的量相同,写出并配平该反应的离子方程式______,0.6mol Cu被硝酸完全溶解后,若用排水法收集这些气体,可得标准状况下的气体体积为______.
(1)制备硝酸的第一步反应是氨的催化氧化生成一氧化氮和水,即4NH3+5O2

4NO+6H2O,将苯滴入浓硝酸和浓硫酸混合液中,并在50℃--60℃反应的化学方程式为:
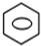
+HNO3(浓)H2SO4(浓) 50-60℃
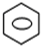
-NO2+H2O,
故答案为:4NH3+5O2

4NO+6H2O;

+HNO3(浓)H2SO4(浓) 50-60℃

-NO2+H2O;
(2)在反应中,硝酸的化合价降低,显示氧化性,同时生成硝酸铜显示了硝酸的酸性,如果得到的NO和NO2物质的量相同,假设均为1mol,则氮元素的电子数为4.所以一参加反应的铜的物质的量为2mol,根据原子守恒来配平方程式即可,2Cu+6H++2NO3-=2Cu2++NO↑+NO2↑+3H2O,0.6mol Cu被硝酸完全溶解后,会生成0.3mol的一氧化氮和0.3mol二氧化氮,若用排水法收集这些气体,二氧化氮能和水反应生成一氧化氮,3NO2+H2O=2HNO3+NO,所以0.3mol二氧化氮会生成0.1mol的一氧化氮,最会获得一氧化氮共0.4mol,体积为:0.4mol×22.4L/mol=8.96 L,故答案为:氧化性、酸性;2Cu+6H++2NO3-=2Cu2++NO↑+NO2↑+3H2O;8.96 L.
