某兴趣小组用如图所示装置做酸碱中和反应实验,试回答:
(1)用胶头滴管吸取盐酸逐滴加入烧杯中,当溶液刚好由______色变成______色时,停止加入盐酸,该反应的化学方程式为______
(2)实验(1)中,某同学不小心又多加了几滴盐酸,这时溶液的pH______7(填“>”“<”或“=”).
(3)若要除去实验(2)中过量的盐酸可选用的试剂是______(填化学式).
(4)中和反应在实际中具有广泛的应用,请举出一个实例:______.
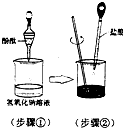
(1)氢氧化钠溶液中滴加酚酞溶液,溶液变红色,当滴加盐酸溶液时盐酸和氢氧化钠发生反应,当两者恰好完全反应时,溶液呈中性,溶液颜色由红色变为无色.故答案为:红;无;HCl+NaOH=NaCl+H2O;
(2)当滴加盐酸的量过量时,溶液呈酸性,溶液颜色不变,但pH<7;故答案为:<;
(3)要除去实验(2)中过量的盐酸时,也就是除去过量的H+,可用碱性溶液,如NaOH(或Na2CO3、NaHCO3、Na20)等;故答案为:NaOH(或Na2CO3、NaHCO3、Na20);
(4)中和反应是酸与碱反应生成盐和水的反应,属复分解反应,在实际中具有广泛的应用,如(用熟石灰)改良酸性土壤、(用氢氧化铝)治疗胃酸过多.故答案为:(用熟石灰)改良酸性土壤、(用氢氧化铝)治疗胃酸过多.
