某同学为研究硝酸与镁的反应,进行图示实验,实验现象及相关数据如下:(a)A中为一定浓度的硝酸与Mg片发生反应,生成的气体通过B后,在B中只生成一种盐,剩余气体遇空气不变色,其体积为原体积的一半.(b)从C进入D中的气体有两种,且体积比为1:1.(c)将D加热一段时间后,E中干燥的红色石蕊试纸逐渐恋蓝.(设实验前,装置中的空气已排尽;气体的体积均在同温同压下测定)
已知:2NO2+2NaOH═NaNO3+NaNO2+H2O,NO2+NO+2NaOH═2NaNO2+H2O,且水蒸气的体积忽略不计,实验中的液体药品均过量.请回答:
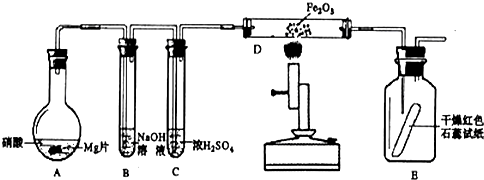
(1)硝酸与Mg片反应生成的气体成分是______(用化学式表示).
(2)硝酸在装置A的反应中所表现的性质有______.
(3)写出D中发生反应的化学方程式______.
(4)若向反应后的A中加入足量的NaOH固体,使产生的气体全部逸出,其体积为硝酸与Mg片反应生成的气体体积的
(同温同压),写出符合上述实验事实的硝酸与Mg片反应的离子方程式______.1 4
NO2气体与NaOH溶液反应的化学方程式为2NO2+2NaOH=NaNO3+NaNO2+H2O,NO与NaOH溶液不反应,但有NO2,发生反应NO2+NO+2NaOH=2NaNO2+H2O,A产生的气体通入B中,在B中只生成一种盐,剩余气体遇空气不变色,说明A产生的气体中有NO和NO2两种气体且两者的比例为1:1;结合(c)可知D中生成的气体是NH3,同时有水生成,反推知由N2和H2合成,即进入D中的气体为N2和H2,二者体积之比为1:1,二者体积之和等于NO和NO2两种气体的体积之和,故Mg和HNO3反应生成的气体有NO、NO2、N2、H24种,且物质的量相等,
向反应后的A中加入足量的NaOH固体,使产生的气体全部逸出,该气体为氨气,说明HNO3的还原产物中还存在NH4+,氨气体积为硝酸与Mg片反应生成的气体体积的
(同温同压),NH4+物质的量和每一种气体的物质的量相等,1 4
(1)由上述分析可知,硝酸与Mg片反应生成的气体成分是NO、NO2、N2、H2,
故答案为:NO、NO2、N2、H2;
(2)反应中硝酸中氮元素在产物中存在与硝酸镁、硝酸铵、NO、NO2、N2中,N元素化合价表示为变化,部分解答,故反应中硝酸起酸性、氧化剂作用,
故答案为:酸性、氧化剂;
(3)由上述分析可知,D中生成NH3,同时有水生成,反应方程式为:N2+3H2
2NH3、3H2+Fe2O3催化剂 . 高温高压
2Fe+3H2O, 高温 .
故答案为:N2+3H2
2NH3、3H2+Fe2O3催化剂 . 高温高压
2Fe+3H2O; 高温 .
(4)向反应后的A中加入足量的NaOH固体,使产生的气体全部逸出,该气体为氨气,说明HNO3的还原产物中还存在NH4+,氨气体积为硝酸与Mg片反应生成的气体体积的
(同温同压),NH4+物质的量和每一种气体的物质的量相等,配平后反应离子方程式为:12Mg+30H++5NO3-=12Mg2++NH4++NO2↑+NO↑+N2↑+H2↑+12H2O,1 4
故答案为:12Mg+30H++5NO3-=12Mg2++NH4++NO2↑+NO↑+N2↑+H2↑+12H2O.
