某科研小组以难溶性钾长石(K2O.Al2O3.6SiO2)为原料,提取A1203、K2CO3等物质,工艺流程如下:
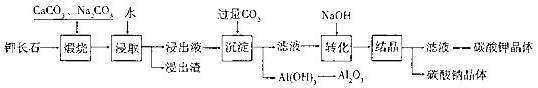
(1)“煅烧”过程中有如下反应发生:
①钾长石中的硅元素在CaCO3作用下转化为CaSiO3,写出SiO2转化为CaSiO3的 化学方程式______
②钾长石中的钾元素和铝元素在Na2CO3作用下转化为可溶性的NaAlO2和 KAlO2,写出Al2O3转化为NaAlO2的化学方程式______.
(2)已知NaAlO2和KAlO2易发生如下反应:AlO
+2H2O⇌Al(OH)3+OH-.“浸取”时,应保持溶液呈______性(填“酸”或“碱”).“浸取”时不断搅拌的目的是______ -2
(3)“转化”时加入NaOH的主要作用是______ (用离子方程式表示).
(4)上述工艺中可以循环利用的主要物质是______、______和水.
(1)①碳酸钙与二氧化硅在高温条件下反应生成硅酸钙和二氧化碳,该反应的化学方程式为:CaCO3+SiO2
CaSiO3+CO2↑, 高温 .
故答案为:CaCO3+SiO2
CaSiO3+CO2↑; 高温 .
②氧化铝和碳酸钠在高温下反应生成偏铝酸钠和二氧化碳,Al2O3+Na2CO3
2NaAlO2+CO2↑, 高温 .
故答案为:Al2O3+Na2CO3
2NaAlO2+CO2↑; 高温 .
(2)偏铝酸根离子是强碱弱酸盐,在酸性溶液中会发生反应生成沉淀或铝离子,在中性溶液中会发生水解生成氢氧化铝,只有在碱性条件下,不反应不水解,所以在须在碱性条件下,“浸取”时不断搅拌能提高浸取速率,
故答案为:碱;提高浸取速率;
(3)碳酸氢根离子与氢氧根离子反应生成碳酸根离子和水,碳酸氢根离子是弱酸的酸根离子不能拆成碳酸根离子和氢离子,离子反应方程式为:HCO3-+2OH-=CO32-+H2O,
故答案为:HCO3-+2OH-=CO32-+H2O;
(4)煅烧时需要碳酸钠,在流程图提取碳酸钾之前可得到碳酸钠,所以碳酸钠为可循环利用的物质,在浸出液中需通二氧化碳,而碳酸钙与二氧化硅、氧化铝和碳酸钠在高温下反应都有二氧化碳生成,所以,二氧化碳是可循环使用的物质,
故答案为:Na2CO3、CO2;
