根据废水中所含有害物质的不同,工业上有多种废水的处理方法.
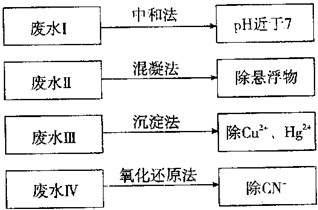
(1)①废水I若采用CO2处理,离子方程式是______.
②废水Ⅱ常用明矾处理.实践中发现废水中的c(HCO-3)越大,净水效果越好,这是因为______.
③废水Ⅲ中的汞元素存在如下转化(在空格上填相应的化学式):Hg2++______═CH3Hg++H+
我国规定,Hg2+的排放标准不能超过0.05mg/L.若某工厂排放的废水1L中含Hg2+3×10-7mo1,是否达到了排放标准______(填“是”或“否”).
④废水Ⅳ常用Cl2氧化CN-成CO2和N2,若参加反应的Cl2与CN-的物质的量之比为5:2,则该反应的离子方程式为______.
(2)化学需氧量(COD)可量度水体受有机物污染的程度,它是指在一定条件下,用强氧化剂处理水样时所消耗的氧化刹的量,换算成氧的含量(以mg/L计).某研究性学习小组测定某水样的化学需氧量(COD),过程如下:
Ⅰ.取V1 mL水样于锥形瓶,加入10.00mL 0.2500mol/L K2Cr2O7溶液.
Ⅱ.加碎瓷片少许,然后慢慢加入硫酸酸化,混合均匀,加热.
Ⅲ.反应完毕后,冷却,加指示剂,用c mol/L的硫酸亚铁铵[(NH4)2Fe(SO4)2]溶液 滴定.终点时消耗硫酸亚铁铵溶液V2 mL.
①I中,量取K2Cr207,溶液的仪器是______.
②Ⅱ中,碎瓷片的作用是______.
③Ⅲ中,发生的反应为:Cr2O72-+6Fe2++14H+═2Cr3++6Fe3+7H2O由此可知,该水样的化学需氧量COD=______(用含c、V1、V2的表达式表示).
(1)①pH接近7,用CO2处理,生成HCO3-,则反应的离子方程式为OH-+CO2=HCO3-,故答案为:OH-+CO2=HCO3-;
②HCO3-和Al3+发生相互促进的水解,生成CO2和Al(OH)3,从而增强净水效果,
故答案为:HCO3-会促进Al3+的水解,生成更多的Al(OH)3,净水效果增强;
③根据电荷守恒可质量守恒可知,应为Hg2+和CH4的反应,
1L水中,n(Hg2+)=3×10-7mo1,则m(Hg2+)=3×10-7mo1×200.6g/mol=6.02×10-5g=0.06mg>0.05mg,所以没有达到排放标准,故答案为:CH4;否;
④废水Ⅳ常用C12氧化CN-成CO2和N2,若参加反应的C12与CN-的物质的量之比为5:2,
则反应的离子方程式为5Cl2+2CN-+4H2O=10Cl-+2CO2+N2+8H+,故答案为:5Cl2+2CN-+4H2O=10Cl-+2CO2+N2+8H+;
(2)①K2Cr207具有强氧化性,应用酸式滴定管或移液管量取,如用碱式滴定管,会腐蚀橡胶管,故答案为:酸式滴定管(或移液管);
②碎瓷片起到防止暴沸的作用,故答案为:防止暴沸;
③n(K2Cr2O7)=0.01L×0.2500mol/L=2.5×10-3mo1,
n(Fe2+)=V2×10-3L×cmol/L=cV2×10-3mol,
由Cr2O72-+6Fe2++14H+═2Cr3++6Fe3++7H2O可知,
水样消耗的n(K2Cr2O7)=2.5×10-3mo1-
×cV2×10-3mol=1 6
×10-3mol,15-cV2 6
得电子:2×(6-3)×
×10-3mol=(15-cV2)×10-3mol,15-cV2 6
根据电子转移,相等于
×(15-cV2)×10-3mol氧气,1 4
m(O)=
×(15-cV2)×10-3mol×32g/mol=8×(15-cV2)×10-3g=8×(15-cV2)mg,1 4
所以:COD=
=8×(15-cV2)mg V1×10-3L
mg/L,8000×(15-cV2) V1
故答案为:
.8000×(15-cV2) V1
