某研究学习小组对“NaOH溶液与稀H2SO4溶液是否恰好反应”进行实验探究.
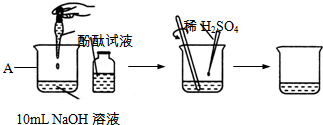
(1)如图是类似教材所示酸与碱反应的实验过程.
①图中仪器A的名称是______.
②向A中加入10mLNaOH溶液,并滴入3滴酚酞试液,再向其中慢慢滴入稀硫酸,并用玻璃棒不断______,使溶液混合均匀,直至溶液的颜色由红色恰好变成______色为止,表明两者发生了反应,该反应的化学方程式为______.
(2)为探究上述酸碱反应后,硫酸是否过量.设计了如下两种方法:
方法①:取少量反应的溶液,用pH试纸检验,测得pH<7,表明硫酸过量.
方法②:取少量反应的溶液,向其中滴加适量的BaCl2溶液,可观察到有白色沉淀产生,表明硫酸过量.
上述两种方法中,你认为正确的是方法______(选填“①”或“②”).请用文字说明另一种方法不合理的原因______.
(1)①图中的A仪器为烧杯.
②图中给出的实验的第一步是向氢氧化钠溶液中滴入了酚酞,所以滴入酚酞后的颜色变化是由无色变红色(酚酞遇碱变红).第二步是滴入适量的硫酸,慢慢滴入且不停搅拌,溶液会由红色变成无色,证明碱被慢慢消耗,从而证明酸和碱发生了反应,氢氧化钠和硫酸发生的是中和反应生成对应的硫酸钠和水,对应方程式为2NaOH+H2SO4═Na2SO4+2H2O.
(2)对于硫酸是否过量的判断实际上是判断溶液中是否依然显酸性.
| 实验方案 | 实验步骤 | 实验现象及反应方程式 | 实验分析 |
| 方法① | pH试纸 | pH<7 | pH小于7证明溶液显酸性,即硫酸是过量的 |
| 方法② | BaCl2溶液 | 出现白色沉淀 H2SO4+BaCl2=BaSO4↓+2HCl;Na2SO4+BaCl2=BaSO4↓+2NaCl | 即使硫酸不过量,先前生成的硫酸钠也能和氯化钡反应生成白色沉淀(或者:反应是通过生成沉淀来进行分析氢离子是否剩余的,而沉淀硫酸钡的生成与氢离子无关,所以不能确定是否硫酸过量) |
故答案为:(1)烧杯;②搅拌;无色; 2NaOH+H2SO4═Na2SO4+2H2O.
(2)①; 即使硫酸不过量,先前生成的硫酸钠也能和氯化钡反应生成白色沉淀(或者:反应是通过生成沉淀来进行分析氢离子是否剩余的,而沉淀硫酸钡的生成与氢离子无关,所以不能确定是否硫酸过量)
