问题
选择题
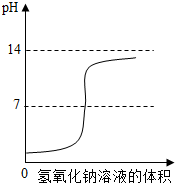
日常生活、工农业生产和科学实验中,需要利用中和反应原理来降低某些环境中酸或碱的含量.学校课外活动小组利用5%的氢氧化钠溶液逐滴滴加到10mL5%的稀盐酸中,将测得溶液pH的变化绘制成右图所示曲线.分析曲线得到的以下说法中,合理的是( )
A.滴入少量氢氧化钠溶液,溶液呈酸性,pH=0
B.滴入过量氢氧化钠溶液,溶液显碱性,pH=14
C.滴入适量氢氧化钠溶液至恰好反应,溶液呈中性,pH=7
D.未滴入氢氧化钠溶液时溶液显酸性,滴入氢氧化钠溶液后溶液显碱性
答案
A、反应前溶液的前点从大于零的某个位置开,所以溶液的PH值不可能等于零,故A错误,
B、滴入多量的氢氧化钠后,图象的走向无限的接近14,但是不会达到14,故B错误,
C、当两者恰好完全反应时,酸碱都没有剩余,生成的氯化钠是强酸强碱盐在溶液中呈中性,所以溶液的PH=7,故C正确,
D、滴入氢氧化钠前,pH值小于7溶液显酸性,但是滴入少量的氢氧化钠时,ph值也不会大于7,故D错误,
故选C.
