实验室中有一瓶KCl和CaCl2的固体混合物,通过下列操作可确定该混合物中KCl和CaCl2的质量比,也可制得纯净的KCl.
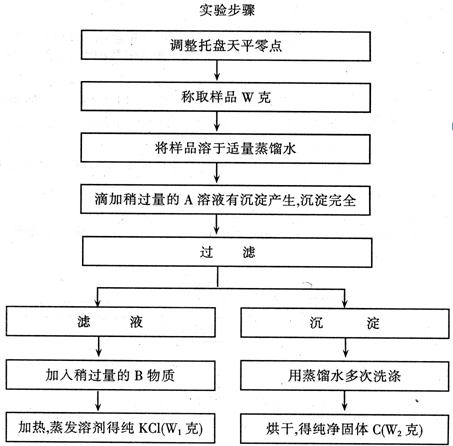
请回答下列问题:
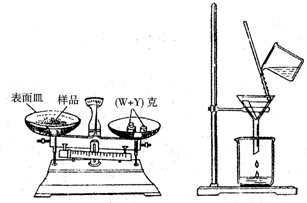
①调整零点时,若指针偏向左边,应将右边的螺丝帽向______移动(填左或右).某学生用已知质量为Yg的表面皿,准确称取Wg样品.他在托盘天平的右盘上放入(W+Y)g砝码,在左盘的表面皿上加入样品,此时指针偏向如图,接下来他的操作应为______.
②实验过程中,加入的A是______,检验A是否过量的方法是______.加入的B是______,B物质需要过量的理由是______.得到的固体C是______,检验沉淀C是否洗净的方法是______.
③过滤时,某学生的操作如图,请用文字说明图中操作的错误______.
④该混合物中KCl与CaCl2质量比的计算式为______.
①托盘天平是根据杠杆原理制成的,指针偏向左边,说明左盘的质量高.因此,若指针偏向左边,应将右边的螺丝帽向右移动;指针向右偏转,说明砝码的质量大于物质的质量,所以应小心加入药品,使指针指向刻度中央.
故答案为:右; 小心加入药品,使指针指向刻度中央.
②加入A物质,能使氯化钙产生沉淀且不引进新的杂质离子,所以应加入碳酸钾溶液,碳酸钾和氯化钙反应生成碳酸钙沉淀和氯化钾;如果碳酸钾过量,溶液中含有碳酸根离子,碳酸根离子和强酸能发生生成二氧化碳气体,所以检验方法是 取上层澄清溶液少许,加盐酸观察是否有无色气体生成,如果有气体生成就说明过量,否则不过量;
加入的A物质是过量的,所以滤液中含有碳酸根离子,碳酸钾和盐酸反应生成氯化钾和二氧化碳、水,且加热溶液能使盐酸挥发,所以选取盐酸除去碳酸根离子;
由以上分析知,得到的固体是碳酸钙;沉淀上容易沾有氯离子,所以洗涤液中含有氯离子,如果沉淀洗涤干净,洗涤液中就没有氯离子,检验方法是:取最后一次洗出液加入AgNO3溶液,观察是否有白色沉淀析出.
故答案为:K2CO3; 取上层澄清溶液少许,加盐酸观察是否有无色气体生成; 盐酸;除CaCl2时混入CO32-,加入过量盐酸除去CO32-,且不影响KCl纯度; CaCO3; 取最后一次洗出液加入AgNO3溶液,观察是否有白色沉淀析出.
③由图知,玻璃棒没有靠在三层滤纸上;漏斗颈底端没有贴在烧杯内壁上.
故答案为:玻璃棒没有靠在三层滤纸上;漏斗颈底端没有贴在烧杯内壁上.
④根据钙原子守恒计算氯化钙的质量.
设氯化钙的质量为x.
CaCO3----CaCl2
100 111
W2 x
x=
g;111W2 100
所以氯化钾的质量为=Wg-
g;111W2 100
所以氯化钾和氯化钙的质量比为
=W- 111W2 100 111W2 100
.100W-111W2 111W2
