为除去粗盐中的Ca2+、Mg2+、SO42-以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):
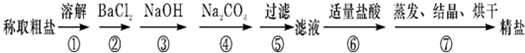
(1)判断BaCl2已过量的方法是______.
(2)第②步中,有关的离子方程式是______.第③步中,有关的离子方程式是______.
(3)若先加适量盐酸再过滤,将对实验结果产生影响,其原因是:______.
(4)为检验精盐纯度,需配制1000mL.0.2mol/L NaCl(精盐)溶液,若定容时观察液面仰视,会造成所配制的溶液浓度(填“偏高”或“偏低”)______.
(1)加入过量氯化钡溶液除去硫酸根离子,检验硫酸根离子已除尽,可静止片刻在上层清液处,滴加一滴氯化钡溶液,不出现浑浊就说明硫酸根离子已经除尽,BaCl2溶液已过量,
故答案为:取少量②中上层清液于试管中,向其中滴加BaCl2溶液,若无沉淀产生,则BaCl2溶液已过量(其他合理答案均可);
(2)②步是加入氯化钡沉淀硫酸根离子,反应的离子方程式为:Ba2++SO42-=BaSO4↓;③步是加入氢氧化钠沉淀镁离子,反应离子方程式为:Mg2++2OH-=Mg(OH)2↓,
故答案为:Ba2++SO42-=BaSO4↓;Mg2++2OH-=Mg(OH)2↓;
(3)若先加适量盐酸再过滤,生成的沉淀如CaCO3、BaCO3会溶解在盐酸中,影响制得精盐的纯度,故答案:会有部分沉淀如CaCO3、BaCO3溶解,从而影响制得精盐的纯度;
(4)容量瓶配制溶液定容时,误差分析依据刻度丁液面分析判断,若观察液面仰视,多加了水,会超出刻度线造成所配制的溶液浓度偏小,故答案为:偏小.
