以下是分析硫铁矿中FeS2含量的三种方法,各方法的操作流程图如下:
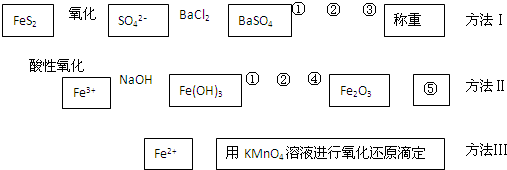
请回答下列问题:
(1)流程图中操作①、②、③分别指的是:①______、②______、③______.
操作④、⑤用到的主要仪器是:④______、⑤______(每空填1~2个仪器).
(2)判断溶液中SO42-离子已沉淀完全的方法是______.
(3)某同学用方法Ⅲ测定试样中Fe元素的含量,准确称取一定量的矿石试样,试样经溶解、预处理后,
(A) 用带有刻度的烧杯配制成100 mL试样溶液
(B) 用量筒量取25.00 mL待测溶液
(C) 并置于锥形瓶中
(D) 用蒸馏水洗涤滴定管后装入KMnO4标准溶液,用该标准溶液滴定待测试样,
(E) 当溶液变成淡紫红色时,停止滴定,如半分钟内不褪色,
(F) 读取并计算滴定管中消耗的KMnO4标准溶液体积,计算试样中的Fe元素含量.
请指出该实验过程中错误操作步骤的编号:______.
(4)某同学采用方法Ⅱ分析矿石中的Fe含量,发现测定结果总是偏高,则产生误差的可能原因是______.
(5)称取矿石试样1.60g,按方法Ⅰ分析,称得BaSO4的质量为4.66g,假设矿石中的硫元素全部来自于FeS2,则该矿石中FeS2的质量分数是______.
(1)方法Ⅰ生成硫酸钡沉淀,经过滤、洗涤、干燥后用天平称得硫酸钡的质量,根据S元素守恒可计算硫铁矿中FeS2含量,方法Ⅱ生成氢氧化铁,经过滤、洗涤后在坩埚中加热分解生成氧化铁,用天平称量氧化铁的质量,根据铁元素守恒硫铁矿中FeS2含量,故答案为:过滤;洗涤;干燥;坩埚、酒精灯;天平;
(2)判断溶液中SO42-离子是否沉淀完全,可取上层清液滴加BaCl2溶液,若无白色沉淀生成,说明SO42-沉淀完全,
故答案为:取上层清液滴加BaCl2溶液,若无白色沉淀生成,说明SO42-沉淀完全;
(3)配制一定物质的量浓度的溶液应在容量瓶中配制,不能用烧杯,难以摇匀,并有较大误差,托盘天平只能精确到0.1,滴定管用蒸馏水洗涤后还应用标准液润洗,否则会导致标准液浓度降低,故答案为:A、B、D;
(4)用方法Ⅱ分析矿石中的Fe含量,发现测定结果总是偏高,说明最后称量的固体的质量偏大,如洗涤不充分、灼烧不充分都会引起固体质量偏大,原因可能有Fe(OH)3沉淀表面积大,易吸附杂质;过滤洗涤时未充分将吸附的杂质洗去;或Fe(OH)3灼烧不充分,未完全转化为Fe2O3;
故答案为:①Fe(OH)3沉淀表面积大,易吸附杂质;②过滤洗涤时未充分将吸附的杂质洗去;③Fe(OH)3灼烧不充分,未完全转化为Fe2O3;
(5)利用关系式法计算:
FeS2~2BaSO4
120g 466g
m 4.66g
m=1.2g,则该矿石中FeS2的质量分数是
× 100%=75.0%,1.2 1.6
故答案为:75.0%.
