欲降低废水中重金属元素铬的毒性,可将Cr2O72-转化为Cr(OH)3沉淀除去.三种金属离子生成沉淀的pH如表.
| 开始沉淀的pH | 完全沉淀的pH | |
| Fe(OH)2 | 7.0 | 9.0 |
| Fe(OH)3 | 1.9 | 3.2 |
| Cr(OH)3 | 6.0 | 8.0 |
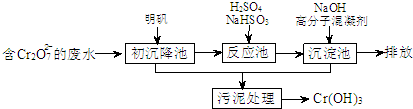
①初沉池中加入明矾作沉降剂,其作用的原理是(用离子方程式表示)______.
②请补充并配平以下反应池中发生主要反应的离子方程式:
______Cr2O72-+______HSO3-+______═______Cr3++______SO42-+______H2O.
③根据“沉淀法”和“中和法”的原理,向沉淀池中加入NaOH溶液,此过程中发生主要反应的离子方程式是:H++OH-=H2O和______.证明Cr3+沉淀完全的方法是______.
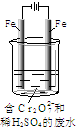
(2)工业可用电解法来处理含Cr2O72-废水.实验室利用如图模拟处理含Cr2O72-的废水,阳极反应是Fe-2e-=Fe2+,阴极反应式是2H++2e-=H2↑.
①Fe2+与酸性溶液中的Cr2O72-反应的离子方程式是______,
②上述反应得到的金属阳离子在阴极区可沉淀完全,从其对水的电离平衡角度解释其原因______.
③若溶液中含有0.01molCr2O72-,则阳离子全部生成沉淀的物质的量是______mol.
(1)①K2SO4﹒Al2(SO4)3﹒24H2O为强电解质,在溶液中完全电离,生成Al3+和SO42-、K+,Al3+能水解生成氢氧化铝胶体:Al3++3H2O=Al(OH)3(胶体)+3H+或Al3++3H2O⇌Al(OH)3+3H+,氢氧化铝胶体具有吸附性,能吸附水中的悬浮物,所以能作净水剂,
故答案为:Al3++3H2O⇌Al(OH)3+3H+;
②反应中,Cr2O72-中铬元素化合价变化为:+6→+3,化合价降低了3价,Cr2O72-中含有两个铬原子,至少降低6价;
HSO3-中硫元素化合价变化为:+4→+6,化合价升高了(6-4)=2价,化合价变化的最小公倍数为6,所以Cr2O72-的化学计量数为1,亚硫酸氢根离子计量数为3,铬离子计量数为2,硫酸根离子计量数为3,再根据电荷守恒,氢离子计量数为5,最后根据质量守恒判断,未知物为水,计量数为4,配平后的方程式为:Cr2O72-+3HSO3-+5H+═2Cr3++3SO42-+4H2O,
故答案为:1;3;5;2;3;4;
③向转化后的废水中加入NaOH溶液,NaOH会和H+发生反应H++OH-═H2O,Cr3+与NaOH发生反应Cr3++3OH-═Cr(OH)3↓,根据表中数据可知,Cr(OH)3沉淀完全时,溶液的pH为8,所以测定溶液的pH,若pH≥8,则证明Cr3+沉淀完全,
故答案为:Cr3++3OH-=Cr(OH)3↓;取沉淀后的上层清液测定其pH,若pH≥8,则沉淀完全;
(2)①亚铁离子与Cr2O72-发生氧化还原反应,Cr2O72-被还原为Cr3+,然后Cr3+生成Cr(OH)3沉淀,重铬酸根具有强氧化性,能将生成的亚铁离子氧化为三价,反应的离子方程式为:6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O,
故答案为:Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O;
②随着电解进行,溶液中c(H+) 逐渐减少,打破了水的电离平衡,促进了水的电离,使溶液中OH-浓度增大,溶液的碱性增强,生成Fe(OH)3和Cr(OH)3沉淀,金属阳离子在阴极区可沉淀完全,
故答案为:水中的H+在阴极区放电,H+浓度减小促使水的电离平衡H2O⇌H++OH-向右移动,阴极区OH-浓度增大与金属阳离子在阴极区结合而沉淀完全;
③根据Cr2O72-+6Fe2++14H+═2Cr3++6Fe3++7H2O,Cr3++3OH-═Cr(OH)3↓、Fe3++3OH-═Fe(OH)3↓知0.01mol Cr2O72-,可生成0.02molCr(OH)3,0.06molFe(OH)3,共0.08mol,
故答案为:0.08.