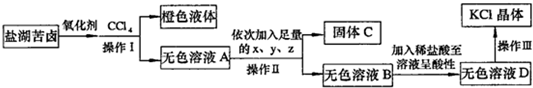
某研究性学习小组拟取盐湖苦卤的浓缩液(富含K+、Mg2+、Br-、SO42-、Cl-等),来制取较纯净的氯化钾晶体及液溴,他们设计了如下流程:
回答以下问题:
(1)操作Ⅰ的名称:______;要从橙色液体中分离出溴,所采取的操作需要的主要玻璃仪器除酒精灯和温度计外,还需要______;
(2)试剂z的化学式为______;检验SO42-已除尽的方法是______;
(3)写出操作Ⅲ的具体操作步骤______;
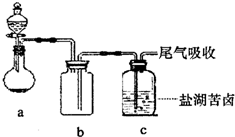
(4)某同学用如右图所示的实验装置制取氧化剂并将其通入盐湖苦卤中,装置b在实验中的作用是______
;若把上述装置中的a、b作为气体的发生、收集装置,装置c可任意改进,则根据下列提供的药品,用这套装置还可以制取的气体是______;若用上述装置中的a、b制取并收集NO,应将装置b如何改进______.
①制NH3:浓氨水和碱石灰 ②制SO2:Cu片和浓硫酸
③制NO:Cu片和稀硝酸 ④制O2:MnO2和双氧水.
(1)氧化剂应为氯气,通入氯气发生:Cl2+2Br-=2Cl-+Br2,加入CCl4,溴易溶于CCl4,溶液分层,用萃取、分液的方法分离;由于溴和CCl4的沸点不同,可用蒸馏的方法分离,蒸馏时用到的仪器有酒精灯、温度计、蒸馏烧瓶、冷凝管、牛角管、锥形瓶等,
故答案为:萃取、分液;蒸馏烧瓶、冷凝管、牛角管、锥形瓶;
(2)除去溶液中的Mg2+、SO42-,应分别加入过量的BaCl2、KOH、K2CO3,类似于粗盐的提纯,加入过量BaCl2可除去SO42-,
加入过量KOH溶液可除去Mg2+,最后加入K2CO3可除去BaCl2,检验SO42-已除尽的方法是取无色溶液D,加入BaCl2溶液,若没有白色沉淀,则SO42-已除尽,
故答案为:K2CO3;取无色溶液D,加入BaCl2溶液,若没有白色沉淀,则SO42-已除尽;
(3)操作Ⅲ为蒸发操作,,蒸发时将溶液倒入蒸发皿中并置于三脚架上;加热并用玻璃棒不断搅拌蒸发皿中的液体,直到出现较多晶体时,停止加热,注意不能直接蒸干,
故答案为:将溶液倒入蒸发皿中并置于三脚架上;加热并用玻璃棒不断搅拌蒸发皿中的液体,直到出现较多晶体时,停止加热;
(4)制备气体时要防止液体倒吸,b的作用为安全瓶,起到防止倒吸作用,由装置图可知,制备气体时不需要加热,并且生成的气体用向下排空气法收集,气体的密度比空气的小,只有氨气符合;NO只能用排水法收集,则b中应装满水.
故答案为:安全瓶;①;将b中装满水.
