Ⅰ.如图是中学化学中常用于混合物的分离与提纯的装置,请根据装置回答问题:
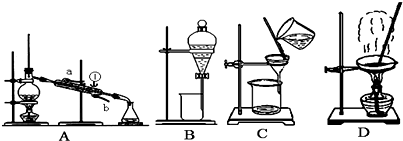
(1)从氯化钾溶液中得到氯化钾固体,选择装置______(填代表装置图的字母,下同);除去自来水中的Cl-等杂质,选择装置______.
(2)从碘水中分离出I2,选择装置______,该分离方法的名称为______.
(3)装置A中①的名称是______,进出水的方向是______.
(4)装置B在分液时为使液体顺利下滴,应进行的具体操作是______.(填代表选项的字母)
A.应该先将分液漏斗上的活塞拿下后再打开旋塞放出液体
B.加热
C.使分液漏斗上的活塞上的凹槽对准分液漏斗上的小孔后再打开旋塞放出液体.
Ⅱ.某同学按下列步骤配制250mL 0.2mol•L-1NaCl溶液,请回答有关问题.
| 实验步骤 | 有关问题 |
| ①计算所需NaCl的质量 | |
| ②称量NaCl固体 | 用托盘天平需要称量NaCl的质量为______g. |
| ③将NaCl加入100mL烧杯中,并加入适量水 | 为了加快溶解速率,可以采取哪些措施:______. |
| ④将烧杯中溶液转移至250mL容量瓶中 | 为了防止溶液溅出,应采取什么措施:______. |
| ⑤向容量瓶中加蒸馏水至刻度线 | 在进行此操作时当加水至刻度线1-2厘米处应如何操作: ______. |
(2)取出该NaCl溶液10mL加水稀释到100mL,稀释后溶液中Na+的物质的量浓度是______.
(3)若进行⑤步操作时加蒸馏水超过刻度线,则需______.
(4)配制NaCl溶液时,下列操作情况会使结果偏高的是______.
A.移液前,容量瓶中有少量蒸馏水
B.溶解搅拌时有液体飞溅
C.定容时俯视容量瓶瓶颈刻度线
D.定容后,倒置容量瓶摇匀经平放静置,液面低于刻度线,再加水定容.
Ⅰ.(1)蒸发可以实现易溶于水的固体和水的分离,从氯化钾溶液中得到氯化钾固体可用蒸发,因蒸馏可以实现水中难挥发性杂质和水的分离,则除去自来水中的Cl─等杂质,可用蒸馏,故答案为:D;A;
(2)碘微溶于水,碘易溶于苯、四氯化碳等有机溶剂,且苯、四氯化碳与水互不相溶,可用萃取法分离,故答案为:B;萃取;
(3)装置A中①的名称是冷凝管,使用时下口进水上口出水,故答案为:冷凝管;b进a出;
(4)在使用分液漏斗时,应该先将分液漏斗上的活塞拿下后再打开旋塞放出液体或打开分液漏斗上端活塞或使凹孔对准小孔,以保证内部液体顺利流下,
故答案为:AC或A或C;
Ⅱ.需氯化钠的质量为m=0.25L×0.2mol•L-1×58.5g/mol=2.925g≈2.9g;
为加快氯化钠溶解可以采取搅拌、加热、研细氯化钠等措施;
为防止溶液溅出通常采取用玻璃棒引流;
定容应注意:加水至液面距离刻度线1~2cm时,改用胶头滴管滴加至溶液凹液面与刻度线水平相切.
故答案为:2.9g;用玻璃棒搅拌;用玻璃棒引流;改用胶头滴管加水至刻度线;
(1)操作步骤有称量、溶解、移液、洗涤、定容、摇匀等操作,一般用托盘天平称量,用药匙取用药品,在烧杯中溶解,冷却后转移到250mL容量瓶中,并用玻璃棒引流,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,所以还需要的仪器为250mL容量瓶,容量瓶在使用前应检查是否漏水,故答案为:250mL 容量瓶;检查是否漏水;
(2)溶液稀释前后溶质的物质的量不变,则c(NaCl)=
=0.02mol/L,故答案为:0.02mol/L;0.2mol/L×0.01L 0.1L
(3)若进行⑤步操作时加蒸馏水超过刻度线,应重新配制,故答案为:重新配制;
(4)A.移液前,容量瓶中有少量蒸馏水,对实验没有影响,故A不选;
B.溶解搅拌时有液体飞溅,会导致溶质减少,浓度减小,故B不选;
C.定容时俯视容量瓶瓶颈刻度线,会导致溶液体积偏小,浓度偏大,故C选;
D.定容后,倒置容量瓶摇匀经平放静置,液面低于刻度线,再加水定容,会导致溶液浓度偏小,故D不选.
故答案为C.
