某氯化铁样品含有少FeC12杂质.现要测定其中铁元素的质量分数,实验按如图1所示步骤进行:
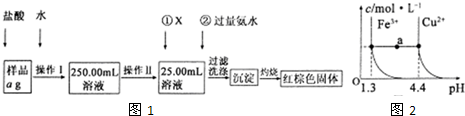
请根据上图流程,回答以下问题:
(1)操作Ⅰ所用到的玻璃仪器除烧杯、玻璃棒外,还必须有______、______(填仪器名称),操作Ⅱ必须用到的仪器是______(填编号).
A.50mL烧杯;B.50mL量筒;C.100mL量筒;D.25mL酸式滴定管.
(2)①的X可选用(填化学式)______,其目的是______.加入氨水要过量的原因是______.
(3)检验沉淀是否已经洗涤干净的操作是______.
(4)若蒸发皿质量是W1 g,蒸发皿与加热后固体总质量W2 g,则样品中铁元素的质量分数是______(列出计算式,不需化简):若固体加热时未充分反应,则最终测量的结果______(“偏大”、“偏小”、“不变”).
(5)已知在常温下Cu2+和Fe3+在溶液中随pH变化时水解的曲线如图2所示.对图中a点的说法正确的是______(填序号).
①加适量NH4C1固体可使溶液由a点沿水平方向变到Cu2+曲线上.
②溶液中a点和水平线在Fe3+和Cu2+曲线上任意截点的c(H+)与c(OH-)乘积相等
③Fe(OH)3、Cu(OH)2在a点代表的溶液中均达到饱和.
(1)由图可知,操作I是将加入盐酸反应的溶液稀释成250.00mL溶液,故需要250mL容量瓶、胶头滴管;操作II是准确量取25.00mL的稀释后的溶液,故应需要滴定管,
故答案为:250mL容量瓶;胶头滴管;D;
(2)①中试剂X为氯水,加氯水就是让+2价铁变为+3价,发生反应为2Fe2++Cl2=2Fe3++2Cl-;加氨水就是使+3价铁充分转化为Fe(OH)3沉淀,发生反应为Fe3++3NH3H2O=Fe(OH)3↓+3NH4+,
故答案为:Cl2;氧化Fe2+生成Fe3+;Fe3+完全转化为沉淀;
(3)沉淀洗涤就是把Cl-或NH4+洗掉,可以检验洗涤液中是否含有Cl-,取少量最后一次洗出液,滴加AgNO3溶液,若无沉淀生成,则证明洗涤干净,
故答案为:取少量最后一次洗出液,滴加AgNO3溶液,若无沉淀生成,则证明洗涤干净;
(4)加热分解所得的物质是Fe2O3,其质量为(W2-W1)g,由于取25mL溶液,故250mL溶液可以得到Fe2O3质量为10(W2-W1)g,
样品中铁元素的质量分数是
×100%,固体加热时未充分反应,剩余固体的质量偏大,则铁元素的质量分数偏大,10(W2-W1)× 112 160 a
故答案为:
×100%;偏大;10(W2-W1)× 112 160 a
(5)①加适量NH4C1固体,pH发生变化,则铜离子浓度变化,而a点沿水平方向变到Cu2+曲线上铜离子浓度不变,故错误;
②温度不变,则水的离子积不变,则溶液中a点和水平线在Fe3+和Cu2+曲线上任意截点的c(H+)与c(OH-)乘积相等,故正确;
③a点不在溶解平衡曲线上,溶解平衡曲线上的任一点均为饱和状态,则Cu(OH)2在a点代表的溶液为不饱和溶液,故错误;
故答案为:②.
