海水是宝贵的自然资源,从海水中可以提取多种化工原料,某工厂对海水综合利用的示意图如下所示:
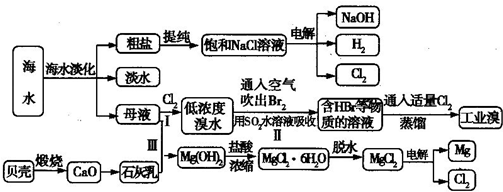
(1)在粗盐中含有SO42-、Ca2+、Mg2+等杂质,电解精制时所用的试剂有①盐酸;②氯化钡溶液;③氢氧化钠溶液;④碳酸钠溶液,则加入试剂的先后顺序是______(填编号).
(2)工业上电解饱和食盐水的离子方程式为______.
(3)步骤Ⅰ中已获得Br2,步骤Ⅱ中又将Br2还原为Br-,其目的是______.
步骤Ⅱ用SO2水溶液吸收Br2,吸收率可达95%,写出有关反应的离子方程式:______.
(4)从步骤Ⅲ得到的Mg(OH)2沉淀中混有少量的Ca(OH)2,除去少量Ca(OH)2的方法是向沉淀中加入______溶液,充分搅拌后经______(填操作方法)可得纯净的Mg(OH)2.
(5)在制取无水氯化镁时需要在干燥的HCl气流中加热MgCl2•6H20的原因:______.
(6)电解无水氯化镁所得的镁蒸气在特定的环境里冷却后即为固体镁,下列物质中可以用作镁蒸气冷却剂的是______(填序号).
A.H2 B.CO2 C.空气 D.O E.水蒸气.
(1)SO42-、Ca2+、Mg2+等分别与BaCl2溶液、Na2CO3溶液、NaOH溶液反应生成沉淀,可再通过过滤除去,Na2CO3溶液能除去过量的BaCl2溶液,盐酸能除去过量的Na2CO3溶液和NaOH溶液,所以应先加BaCl2溶液再加Na2CO3溶液,最后加入盐酸,所以正确顺序为②④③①或③②④①或②③④①;
故答案为:②④③①或③②④①或②③④①;
(2)电解过程中阳极上氯离子失电子发生氧化反应,2Cl--2e-=Cl2↑;阴极上是氢离子得到电子生成氢气,电极反应为:2H++2e-=H2↑;电解池中反应的离子方程式为:2Cl-+2H2O
Cl2↑+H2↑+2OH-; 电解 .
故答案为:2Cl-+2H2O
Cl2↑+H2↑+2OH-; 电解 .
(3)步骤Ⅰ中已获得Br2,步骤Ⅱ中又将Br2还原为Br-,目的是低浓度的Br2溶液在提取时消耗过多的原料和能源,转化为HBr后易被氧化剂氯气氧化为溴单质,用于富集溴元素;
用SO2水溶液吸收Br2的原理方程式为:Br2+SO2+2H2O=4H++SO42-+2Br-,
故答案为:富集溴元素;Br2+SO2+2H2O═4H++SO2-4+2Br-;
(4)Ca(OH)2能与氯化镁溶液反应生成Mg(OH)2沉淀和氯化钙,氯化钙溶于水,可用过滤的方法分离出Mg(OH)2沉淀;
故答案为:氯化镁;过滤;
(5)氯化镁中的镁离子易水解,在干燥的HCl气流中,抑制了MgCl2水解,且带走MgCl2•6H2O受热产生的水汽,故能得到无水MgCl2;
故答案为:在干燥的HCl气流中,抑制了MgCl2水解,且带走MgCl2•6H2O受热产生的水汽,故能得到无水MgCl2;
(6)能和金属镁发生反应的气体:氮气、氧气、二氧化碳、水,所以可以用氢气做镁蒸气的冷却剂;
故选:A;
