X、Y、Z三种可溶性盐,其阳离子分别Ba2+、Cu2+、Ag+中的某一种,阴离子分别是Cl-、SO42-、NO3-中的某一种.现做以下实验:
①将三种盐各取少量,分别溶于盛有5mL蒸馏水的三支试管中,只有X盐溶液呈蓝色.
②分别向三支试管中加入2mL稀盐酸,发现Y盐溶液中产生白色沉淀,Z盐溶液无明显现象.
(1)根据上述事实,推断这四种盐的化学式分别为:
X______ Y______ Z______
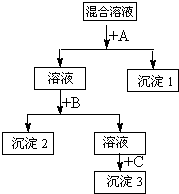
(2)若上述三种阳离子Ba2+、Cu2+、Ag+对应的盐都为硝酸盐,将其混合配成溶液,选择合适试剂,将这三种离子逐一沉淀分离.其流程图如图:
部分物质溶解性表
| Ba2+ | Cu2+ | Ag+ | |
| Cl- | 溶 | 溶 | 不 |
| CO 32- | 不 | 不 | 不 |
| SO 42- | 不 | 溶 | 不 |
| S2- | 溶 | 不 | 不 |
②写出混合液+A的离子方程式______.
③若C为Na2S,且它与B属于同一类盐,则B试剂的名称是______.______.
(1)X、Y、Z三种可溶性盐,其阳离子分别Ba2+、Cu2+、Ag+中的某一种,阴离子分别是Cl-、SO42-、NO3-中的某一种.依据离子共存可知,Ag+只能和NO3-形成盐溶液硝酸银溶液,硫酸根离子只能和铜离子形成硫酸铜溶液,另一种是氯化钡溶液;将三种盐各取少量,分别溶于盛有5mL蒸馏水的三支试管中,只有X盐溶液呈蓝色.说明X为铜盐为硫酸铜;分别向三支试管中加入2mL稀盐酸,发现Y盐溶液中产生白色沉淀,证明是硝酸银溶液,Z盐溶液无明显现象为氯化钡溶液;X:CuSO4 Y:AgNO3 Z:BaCl2
故答案为:CuSO4:AgNO3:BaCl2;
(2)依据物质溶解度和流程可知,先加入盐酸A沉淀银离子,过滤然后加入硫酸盐溶液B沉淀钡离子,最后加入硫化钠C沉淀铜离子;
①依据沉淀顺序和溶解度分析判断,沉淀1的化学式AgCl;
故答案为:AgCl;
②混合液+A的反应是利用氯离子沉淀银离子,反应的离子方程式Ag++Cl-═AgCl↓;
故答案为:Ag++Cl-═AgCl;
③若C为Na2S,且它与B属于同一类盐,所以可以是硫酸钠或硫酸氢钠;
故答案为:硫酸钠或硫酸氢钠;
