小刚同学用MnO2和浓HCl制氯气(反应的化学方程式为MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O)并设计如下实验装置用于制取纯净的无水氯化铜.回答有关问题: △ .
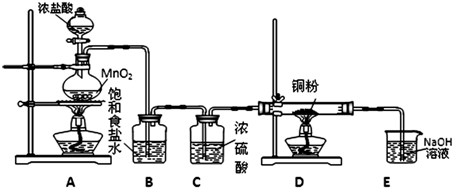
(1)装置B的作用是______,装置C的作用是______.
(2)装置D中发生反应的化学方程式为______.
(3)装置E的作用是______.
(4)装置A中,如果反应产生氯气的体积为2.24L(标况),则反应中被氧化的HCl的物质的量为______.
(5)工业上将氯气通入石灰乳可制取漂白粉,化学反应方程式为______.
(6)工业制取漂白粉的氯气可通过电解饱和食盐水得到.在电解食盐水之前,需要提纯食盐水.为了除去粗盐中的Ca2+、Mg2+、SO42-及泥沙,可将粗盐溶于水,然后进行下 * * 项操作,正确的操作顺序是______.
①过滤 ②加过量的NaOH溶液 ③加适量的盐酸 ④加过量的Na2CO3溶液 ⑤加过量的BaCl2溶液
A、①④②⑤③B、④①②⑤③C、②⑤④①③D、⑤②④③①
(1)实验室制备氯气中含有氯化氢和水蒸气,需要用饱和食盐水除去氯化氢,浓硫酸干燥氯气;
故答案为:除去Cl2中混有的HCl,除去Cl2中混有的水蒸气;
(2)装置D中是干燥的氯气和铜加热发生的反应,发生反应的化学方程式为:Cu+Cl2
CuCl2; △ .
故答案为:Cu+Cl2
CuCl2; △ .
(2)氯气有毒污染空气,不能排放到空气中,需要用氢氧化钠溶液吸收;
故答案为:吸收多余的Cl2,防止污染空气;
(3)装置A中,如果反应产生氯气的体积为2.24L(标况)物质的量为0.1mol,则反应中被氧化的HCl的物质的量为0.2mol;
故答案为:0.2mol;
(5)氯气和氢氧化钙反应生成氯化钙、次氯酸钙和水,反应的化学方程式为:2Ca(OH)2+2Cl2=Ca(ClO)2+CaCl2+2H2O;
故答案为:2Ca(OH)2+2Cl2=Ca(ClO)2+CaCl2+2H2O;
(6)镁离子用氢氧根离子沉淀,加入过量的氢氧化钠可以将镁离子沉淀,硫酸根离子用钡离子沉淀,加入过量的氯化钡可以将硫酸根离子沉淀,至于先除镁离子,还是先除硫酸根离子都行,钙离子用碳酸根离子沉淀,除钙离子加入碳酸钠转化为沉淀,但是加入的碳酸钠要放在加入的氯化钡之后,这样碳酸钠会除去反应剩余的氯化钡,离子都沉淀了,在进行过滤,最后再加入盐酸除去反应剩余的氢氧根离子和碳酸根离子,所以正确的顺序为:②加过量的氢氧化钠溶液 ⑤加过量的氯化钡溶液 ④加过量的碳酸钠溶液 ①过滤 ③加适量盐酸;②⑤可互换;
故答案为:C;
