海水是巨大的资源宝库,海水淡化及其综合利用具有重要意义.请回答下列问题:
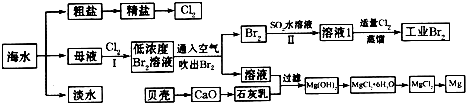
(1)请列举海水淡化的一种方法______.
(2)在实验室中可以用萃取的方法提取溴,可选用的试剂是______,所用主要仪器的名称是______.
(3)步骤I已经获得Br2,步骤II又将Br2还原为Br-,其目的是______.
(4)写出步骤II反应的离子方程式______.
(5)Mg(OH)2沉淀中混有Ca(OH)2,可选用______溶液进行洗涤除去.
(6)将MgCl2•6H2O直接加热能否得到MgCl2固体?______.用化学方程式解释出原因______.
(1)工业常用蒸馏法或电渗析法淡化海水,故答案为:蒸馏法(或电渗析法);
(2)实验室可用四氯化碳作为萃取剂萃取溴,所用的主要仪器为分液漏斗,故答案为:CCl4;分液漏斗;
(3)步骤I已经获得Br2浓度较低,应进行富集,与二氧化硫反应后得到浓度角度的溴化氢溶液,然后通入氯气可得到纯溴,起到浓缩、提纯溴元素的作用,故答案为:浓缩、提纯溴元素(或富集溴元素);
(4)步骤II为二氧化硫和溴的氧化还原反应,反应的离子方程式为Br2+SO2+2H2O=4H++SO+2Br-,
故答案为:Br2+SO2+2H2O=4H++SO+2Br-;
(5)氢氧化镁的溶解度比氢氧化钙小,可加入氯化镁除去氢氧化钙,故答案为:氯化镁或MgCl2;
(6)MgCl2晶体在加热条件下易水解,最终得到MgO固体,
反应的相关方程式为MgCl2+2H2O
Mg(OH)2+2HCl↑,Mg(OH)2 加热 .
MgO+H2O或MgCl2+H2O △ .
MgO+2HCl↑, △ .
故答案为:否;MgCl2+2H2O
Mg(OH)2+2HCl↑,Mg(OH)2 加热 .
MgO+H2O或MgCl2+H2O △ .
MgO+2HCl↑. △ .
