某课外小组在实验室制备氨气,并进行有关氨气的性质探究.
(1)该小组同学加热生石灰与氯化铵的混合物制取干燥的氨气.
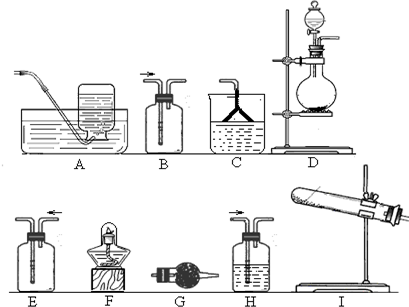
①应该选用的仪器及装置有(填字母) .
②生石灰与氯化铵反应生成氨气的化学方程式为 .
(2)该小组同学设计如图所示装置探究氨气的还原性.
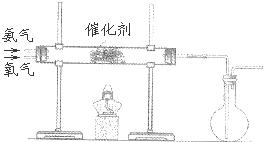
在上述过程会同时发生多个反应,写出其中属于置换反应的化学方程式 .若实验时通入氨气的速率过快,在烧瓶中会出现白烟,该物质的化学式为 .
(3)该小组同学以氨气和二氧化碳为原料制备碳酸氢铵.
①甲同学先将二氧化碳通入水中,充分溶解后,再通入氨气;乙同学先将氨气通入水中,充分溶解后,再通入二氧化碳.合适的方案是 (填“甲”或“乙”),原因是 .
②检验产物中有NH4+的方法为 .
(1)①实验室制备氨气用熟石灰用氯化铵在加热条件下制备氨气,氨气为碱性气体,应用碱石灰干燥,可用排空气法收集,氨气极易溶于水,尾气吸收应防止溶液倒吸,所用的装置分别有I、F、G、E、C,故答案为:I、F、G、E、C;
②氨气加热时分解生成氨气和氯化氢气体,氯化氢与氧化钙反应生成氯化钙和水,生石灰与氯化铵反应的化学方程式为
CaO+2NH4Cl
CaCl2+2NH3↑+H2O, △ .
故答案为:CaO+2NH4Cl
CaCl2+2NH3↑+H2O; △ .
(2)氨气具有还原性,在加热条件下与氧气发生置换反应生成氮气和水,反应的方程式为4NH3+3O2
N2+6H2O,氨气还能被氧化为NO和水,进而与氧气反应生成硝酸,如通入氨气过快,则有生成NH4NO3,产生白烟, △ .
故答案为:4NH3+3O2
N2+6H2O;NH4NO3; △ .
(3)①二氧化碳微溶于水,先通入二氧化碳,溶液中生成极少量的碳酸,再通入氨气,生成的产物量少,且易生成碳酸铵,氨气在水中溶解度很大,先通入氨气,溶液中生成较多的一水合氨,再通入CO2,生成的产物量多,且易生成碳酸氢铵,故乙方案正确.
故答案为:乙;二氧化碳在水中溶解度较小,先通入二氧化碳,再通入氨气,生成的产物量少,且易生成碳酸铵; 氨气在水中溶解度很大,先通入氨气,再通入CO2,生成的产物量多,且易生成碳酸氢铵;
②检验NH4+离子时,加入碱在加热条件下反应生成氨气,氨气水溶液呈碱性,可使湿润的红色石蕊试纸变蓝,
故答案为:取少量产物放入试管中,加入浓NaOH溶液,加热,在试管口放置湿润的红色石蕊试纸,若试纸变蓝,则证明产物中有NH4+.
