问题
问答题
小明同学在烧杯中加入配得的20%氢氧化钠溶液20g,再逐滴加入该盐酸.用pH测定仪测定滴加过程中溶液的pH.图2为测定仪打印出的滴加盐酸的质量与溶液pH的关系图.
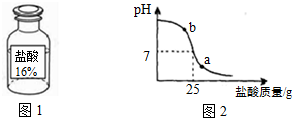
①a点对应的溶液呈______(填“酸性”、“碱性”或“中性”);b点对应的溶液中的溶质为______(写化学式).
②请以此次测定的数据,列式计算该盐酸的实际质量分数?
(3)该盐酸的实际质量分数与标签上标出的质量分数不一致的可能原因______(不考虑误差).
答案
①由图示可知,当滴加盐酸到图象中b点时,溶液显碱性,氢氧化钠的量过量,盐酸全部参加反应生成了氯化钠,还有剩余的氢氧化钠,所以,溶液中的溶质是:NaOH、NaCl.
②由图示可知,当滴加盐酸到C点时,溶液的pH=7,25g的盐酸与20g40%的氢氧化钠溶液恰好完全反应.
设25g的盐酸中溶质的质量为x
HCl+NaOH=NaCl+H2O
36.540
x 8g
=36.5 40 x 8g
解得:X=7.3g
该盐酸的实际质量分数是
×100%=29.2%7.3g 25g
(3)盐酸具有挥发性,是导致盐酸溶液溶质质量分数减少的原因;
答案:
(1)酸性 NaOH、NaCl
(2)29.2%
(3)盐酸有挥发性
