实验桌上有六瓶试剂,只知其可能为醋酸、盐酸、硫酸、氢氧化钾、氢氧化钙以及氨水。该同学取出其中两瓶,进行简易分析实验以辨识二者成分。
实验记录以下:
 实验I 从第一瓶溶液中取出25.00 mL,以标准NaOH溶液滴定,滴定结果列于表1中。
实验I 从第一瓶溶液中取出25.00 mL,以标准NaOH溶液滴定,滴定结果列于表1中。
| 体积(NaOH)/mL | pH | ||
| 5.0 | 2.2 | ||
| 10.0 | 2.4 | ||
| 3.0 | ||
| 24.0 | 3.8 | ||
| 24.8 | 4.5 | ||
| 25.0 | 7.0 | ||
| 25.2 | 9.5 | ||
| 26.0 | 10.0 | ||
| 30.0 | 10.7 |
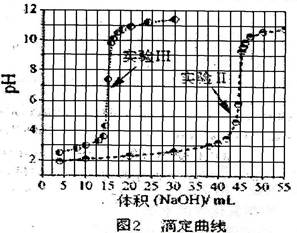
实验Ⅱ 从第一瓶溶液中取25.00 mL后,加入10.00 mL、0.01000 mol/L 的硫酸,再以同一标准NaOH溶液滴定,滴定结果绘于图2中。
实验Ⅲ 从第一瓶与第二瓶溶液中分别取出25.00 mL与10.00 mL,相互混合之后,再以标NaOH溶液滴定。滴定结果也绘于图2中。
实验IV 完成实验III后,再加入数滴BaCl2,溶液并无沉淀出现,但若改加草酸钠,则溶液出现白色沉淀。
(1)进行实验I时,若用酚酞作指示剂,判断达滴定终点对的依据是:_____________________。
(2)计算标准NaOH溶液的浓度______________mol/L。
(3)第二瓶溶液成分及其物质的量浓度_______________________、_______________mol/L。

(1)滴定终点是恰好变色且30S再改变颜色。
(2)由图表中的数据直接展开计算即可。
