加碘食盐中加入的碘酸钾是一种白色结晶粉末,常温下很稳定,加热至560℃开始分解.在酸性条件下碘酸钾是一种较强的氧化剂,可与碘化物、亚硫酸盐等还原性物质反应.
(1)工业生产碘酸钾的流程如下:
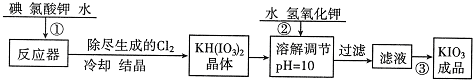
已知步骤①反应器中发生的反应为6I2+11KClO3+3H2O=6KH(IO3)2+5KCl+3Cl2↑.其中KH(IO3)2中I元素的化合价是______.碘酸钾的溶解度见表:
| 温度/℃ | 20 | 40 | 60 | 80 |
| KIO3/100gH2O | 8.08 | 12.6 | 18.3 | 24.8 |
(2)加碘食盐中碘元素的测定.
①已知:KIO3+5KI+3H2SO4=3K2SO4+3I2+3H2O;I2+2S2O32-=2I-+S4O62-
学生甲设计的实验步骤如下:
步骤1:准确称取wg食盐,加适量蒸馏水使其完全溶解;
步骤2:用稀硫酸酸化所得食盐溶液,加入过量KI溶液充分混合;
步骤3:以淀粉为指示剂,逐滴加入2.0×10-3mol•L-1的Na2S2O310.0mL,恰好反应完全.则食盐样品中的碘元素含量是______mg•kg-1(以含w的代数式表示).
②学生乙另取纯净的NaCl进行了下列实验:
| 实验步骤 | 实验操作 | 实验现象 |
| 步骤1 | 取1g纯净的NaCl,加3mL水配成溶液. | 溶液无变化 |
| 步骤2 | 滴入5滴淀粉溶液和1mL0.1 mol•L-1KI溶液,振荡. | 溶液无变化 |
| 步骤3 | 然后再滴入1滴1 mol•L-1的H2SO4,振荡. | 溶液变蓝色 |
③根据学生乙的实验结果,学生甲测得的食盐中碘元素的含量可能______(填“偏高”、“偏低”或“准确”).原因是______.
(1)KH(IO3)2中钾元素化合价是+1,氢元素化合价+1,氧元素的化合价是-2价,根据化合价规则可以确定碘元素的化合价是+5,碘酸钾的物质的量随着温度升高而增大,所以从碘酸钾溶液获得晶体可以采用降温结晶的方法,故答案为:+5;降温结晶;
(2)①根据化学方程式:KIO3+5KI+3H2SO4=3K2SO4+3I2+3H2O;I2+2S2O32-=2I-+S4O62-,可以得出Na2S2O3和KIO3之间的关系式,设碘酸钾的物质的量是x,
2S2O32-~I2 ~
KIO31 3
21 3
2.0×10-3mol•L-1×0.010L x
=2 2×10-5
,解得x=1 3 x
×10-5mol,1 3
食盐样品中的碘元素含量是
×100%=
×10-5×1271 3 w
(或写成1270 3w
)mg•kg-1423.33 w
故答案为:
(或写成1270 3w
);423.33 w
②碘单质遇到淀粉会显示蓝色,因为发生反应:4I-+4H++O2=2I2+2H2O,故答案为:4I-+4H++O2=2I2+2H2O;
③过量的I-会被空气中的氧气氧化为I2,所以学生甲测得的食盐中碘元素的含量会偏高,故答案为:偏高;过量的I-会被空气中的氧气氧化为I2.
