(1)合成氨工业对化学工业和国防工业具有重要意义.工业合成
氨的原理是:N2+3H2
2NH3△H<0,生产流程如图1所示.20-50MPa 500℃、铁触煤
①X的化学式为______;
②图中条件选定的主要原因是(选填字母序号)______;
A.升高温度、增大压强均有利于氨的合成
B.铁触媒在该温度时活性大
C.工业生产受动力、材料、设备等条件的限制
③改变反应条件,会使平衡发生移动.图2表示随条件改变,氨气的百分含量的变化趋势.当横坐标为压强时,变化趋势正确的是(选填字母序号)______,当横坐标为温度时,变化趋势正确的是(选填字母序号)______.
(2)常温下氨气极易溶于水,其水溶液可以导电.
④用方程式表示氨气溶于水且显弱碱性的过程:______;
⑤氨水中水电离出的c(OH-)______ 10-7 mol•L-1(填写“>”、“<”或“=”);
⑥将相同体积、相同物质的量浓度的氨水和盐酸混合后,溶液中离子浓度由大到小依次为______.
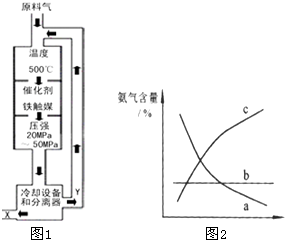
①合成氨工业有下列流程:原料气制备、原料气净化和压缩、氨的合成、氨的分离,从图1生产流程知,原料气氮气和氢气,经过氨的合成、氨的分离,所以X为氨气,Y为氮气和氢气的混合气,再循环利用,故答案为:NH3;
②A.升高温度,能使反应速率加快,但该反应正反应为放热反应,升高温度,平衡向逆反应方向移动,不利于氨的合成;增大压强,能使反应速率加快,反应也向正反应方向移动,但过高的压强,反应成本高,故A错误;
B.实际生产中采用400~500℃的高温,催化剂的催化活性最高,可以增加反应速率,缩短达到平衡的时间;故B正确;C.合成氨工业的原理是:N2+3H2
2NH3△H<0,从化学平衡的角度看,温度越低,压强越大,越有利于合成氨,工业生产以经济利益最大化为目的,所以工业生产受动力、材料、设备等条件的限制,目前的生产条件为:催化剂-铁触媒,温度-400~500℃,压强-30~50MPa,故C正确;20-50MPa 500℃、铁触煤
故答案为:BC.
③合成氨工业的原理是:N2+3H2
2NH3△H<0,因△H<0,从化学平衡的角度看,正反应为放热反应,温度越低,越有利于合成氨,增加温度,平衡向逆反应方向移动,氨气的百分含量减少;正反应为体积缩小的反应,所以压强越大,越有利于合成氨,增大压强时平衡向右进行,氨气的百分含量增大,结合图象可以知道c符合要求.又因为合成氨反应是一个放热反应,可以得出随着温度的升高,平衡向氨气减少的方向移动,结合图象可以知道a符合要求;答案为:c;a;20-50MPa 500℃、铁触煤
(2)④氨气和水反应生成氨水,氨水电离生成氢氧根离子和铵根离子,方程式为:NH3+H2O⇌NH3•H2O⇌NH4++OH-,
故答案为:NH3+H2O⇌NH3•H2O⇌NH4++OH-;
⑤水电离出氢离子和氢氧根离子,氨水是弱碱,电离出电离生成氢氧根离子和铵根离子,对水的电离起抑制作用,所以水电离出的c(OH-)<10-7 mol•L-1,故答案为:<;
⑥将相同体积、相同物质的量浓度的氨水和盐酸混合后,反应生成氯化铵溶液,铵根离子水解,c(Cl-)>c(NH4+),氯化铵为强酸弱碱盐,水解后溶液呈酸性,c(H+)>c(OH-),水解极其微弱,所以c(NH4+)>c(H+),
故答案为:c(Cl-)>c(NH4+)>c(H+)>c(OH-);
