为测定某稀盐酸溶液溶质的质量分数,取100g该溶液于烧杯中,向烧杯中滴入16%的NaOH溶液,用pH计测得滴入NaOH溶液质量与pH的关系如右图所示。
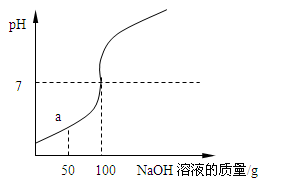
(1)在a点时,烧杯中溶液的溶质是 ,此时向溶液中滴入紫色石蕊试液,溶液呈 色。
(2)通过计算求盐酸溶液溶质的质量分数。
(3)若改用16%的氢氧化钾溶液来测定盐酸溶质的质量分数,当滴入KOH溶液的质量为100g时,溶液的pH 7(填“大于”、“小于”或“等于”)。
(1)HCl、NaCl(2分,漏1个得1分)
(2)设100g稀盐酸中含HCl的质量为x
NaOH+ HCl====NaCl+H2O (1分)
40 36.5
100g×16% x (1分 )
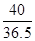 =
=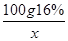 (1分)
(1分)
X=14.6g (1分)
所用稀硫酸的溶质质量分数=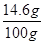 ×100%="14.6%" (1分)
×100%="14.6%" (1分)
(3)小于 (2分)
分析:(1)由图示可知,滴加氢氧化钠溶液到100克时,氢氧化钠溶液与稀盐酸完全反应,当滴加稀盐酸至图中a点时,稀盐酸还没有完全反应,这时溶液中的溶质就有氯化钠和氯化氢两种.
(2)根据反应的氢氧化钠的质量,利用化学方程式求出反应的盐酸的溶质的质量.进而求出盐酸的质量分数.
(3)欲正确解答本题,需根据NaOH和KOH的相对分子质量判断反应后溶液的酸碱性.
解答:解:(1)由图示可知,滴加氢氧化钠溶液到100克时,氢氧化钠溶液与稀盐酸完全反应,当滴加稀盐酸至图中a点时,稀盐酸还没有完全反应,盐酸就有剩余,此时向溶液中滴入石蕊,溶液显红色.
故答案为:NaCl和HCl;红色.
(2)设100g稀盐酸中含HCl的质量为x
NaOH+HCl═NaCl+H2O
40 36.5
100g×16% x
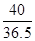 =
=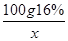
X=14.6g
所用稀盐酸的溶质质量分数=
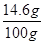 ×100%=14.6%
×100%=14.6%
(3)NaOH的相对分子质量比KOH小,故等质量的NaOH和KOH,NaOH的分子更多,故用KOH 100克不会完全中和,反应后盐酸有剩余,溶液呈酸性,PH小于7
故答案为:小于
点评:做这类题目要会看折点,折点是指图象在变化过程中方向发生了大的转变的那个点.它的出现往往是两个变量中某一变量单方面停止造成的.如果图象涉及化学反应,折点通常是该反应的结束点.
