氮化铝(AlN)是一种新型无机材料,广泛应用于集成电路生产领域.某氮化铝中含有碳或氧化铝杂质,现用图I中的一些装置来进行检验,使氮化铝样品和NaOH溶液反应:
AlN+NaOH+H2O═NaAlO2+NH3↑
根据反应中所生成氨气的体积来测定样品中的氮化铝的质量分数,并根据实验现象来确定杂质的成分(实验中导管体积忽略不计)
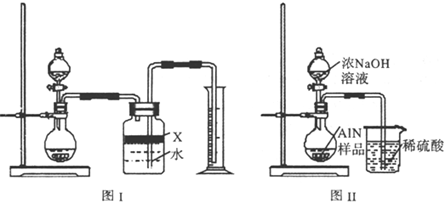
(1)实验有关操作为:a、往烧瓶中放入适量的AIN样品:b、从分液漏斗往烧瓶中加入过量的浓NaOH; C、检验装置的气密性;d、测定收集到水的体积.
正确的操作顺序为:______.
(2)本试验中(图I)检査装置气密性的方法是:______.
(3)广口瓶中的试剂X可选用______.(填选项的标号)
A.汽油 B.酒精 C.植物油 D.CCl4
(4)实验结束后,若观察到烧瓶中还有固体,则样品中含有的杂质是______.
(5)若实验中测得样品的质量为w g,氨气的体积为aL(标况下),则样品中AIN的质量分数为:______.
(6)有人改用图II装置进行同样实验,通过测定烧杯中硫酸的增重来确定样品中AIN的质量分数.你认为是否可行?______ (填入“可行”、“不可行”),原因是______.
:(1)应先进行装置气密性检验,然后依次加入固体药品、液体药品,最后进行气体排出水的测量,确定产生气体体积;
故答案为:c、a、b、d;
(2)通过微热或用手握热使装置内气体使气体体积变大,如果装置漏气则不会观察到装置内有明显变化;如果气密性良好,广口瓶中右侧导管水柱上升,松手后水柱回落;
故答案为:关闭分液漏斗活塞,用水紧握握热锥形瓶,广口瓶中右侧导管水柱上升,松手后水柱回落,证明气密性好;
(3)酒精、汽油虽然都不能与氨气发生反应,但它们却都极易挥发,挥发出来的气体对实验有影响而且挥发完后不能再起到隔离氨气与水接触的作用;同时由于酒精易溶于水,也不能达到隔离的目的;CCl4密度大于水,不能起到隔离作用.而植物油既不溶于水,密度小于水也不易挥发,可以把氨气与水进行隔离;
故答案为:C;
(4)氮化铝中含有碳或氧化铝杂质,氧化铝易溶于NaOH溶液,而实验结束后,若观察到锥形瓶中还有固体,说明固体不溶于氢氧化钠溶液,所以杂质是碳;
故答案为:碳.
(5)氨气的体积为aL(标况下)的物质的量为
=aL 22.4L/mol
mol,由方程式AlN+NaOH+H2O=NaAlO2+NH3↑可知,样品中AlN的物质的量为=a 22.4
mol,所以AlN的质量为a 22.4
mol×41g/mol=a 22.4
g,样品中AIN的质量分数为41a 22.4
×100%=
g41a 22.4 wg
%.4100a 22.4w
故答案为:
%. 4100a 22.4w
(6)氨气极易溶于稀硫酸而出现倒吸,因此,该装置不能准确测量产生氨气的量;可在导管末端连接漏斗倒扣在液面上,刚氨气大量吸收时,烧杯内液面下降而脱离接触,可以防止稀硫酸的倒吸;
故答案为:不可行;氨气极易被吸收,发生倒吸现象.
