请回答下列实验室中制取气体的有关问题.
(1)如图是用KMnO4与浓盐酸反应制取适量氯气的简易装置.
①装置B,C的作用分别是:B______C______.
②写出该反应的离子方程式为______.
③若实验室欲制取5瓶容积为100mL的氯气(室温下,氯气的密度为2.90g/L),理论需要KMnO4固体的质量为______g(保留2位小数,浓盐酸过量),反应中发生转移的电子的物质的量为______mol(保留2位小数).
(2)在实验室欲制取适量NO气体.
①如图(Ⅰ~Ⅳ)中最适合完成该实验的简易装置是______(填序号).
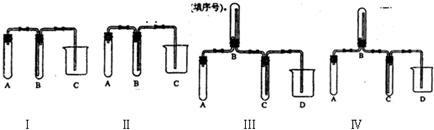
②根据所选的装置完成列表(不需要的可不填).
| 应加入的物质 | 所起的作用 | |
| A | ______ | ______ |
| B | ______ | ______ |
| C | ______ | ______ |
| D | ______ | ______ |

(1)①生成的氯气密度比水大,可用向上排空气法收集,则B为收集装置,C为防止倒吸的装置,可起到防止D中的液体倒吸进入集气管B中,
故答案为:向上排气法收集氯气;安全作用,防止D中的液体倒吸进入集气管B中;
②实验室用高锰酸钾和浓盐酸反应制备氯气,发生:2MnO4-+10Cl-+16H+=2Mn2++5Cl2↑+8H2O,
故答案为:2MnO4-+10Cl-+16H+=2Mn2++5Cl2↑+8H2O;
③制取5瓶容积为100mL的氯气,质量为5×100×10-3L×2.90g/L=1.45g,n(Cl2)=
,则m(KMnO4)=1.45g 71g/mol
×1.45g 71g/mol
×158g/mol=1.29g,反应中发生转移的电子的物质的量为2 5
×2=0.04mol,1.45g 71g/mol
故答案为:1.29;0.04;
(2)①NO易与空气中氧气反应,则应用排水法收集,收集时进气管较短,则应选择Ⅱ装置,故答案为:Ⅱ;
②Ⅱ装置中A加入稀硝酸和铜,为气体发生装置,B为气体的收集装置,用排水法收集,C为接受B中排出的水的装置,
故答案为:
| 应加入的物质 | 所起的作用 | |
| A | 铜屑和稀硝酸 | 产生NO气体 |
| B | 水 | 排水收集NO气体 |
| C | 接收B中排出的水 | |
| D |
故答案为:反应开始时,A中铜表面出现无色小气泡,反应速率逐渐加快:A管上部空间由无色逐渐变为浅红棕色,随反应的进行又逐渐变为无色;A中的液体由无色变为浅蓝色;B中的水面逐渐下降,B管中的水逐渐流入烧杯C中.
