为除去粗盐中的Ca2+、Mg2+、Fe3+、SO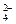 以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):
以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):
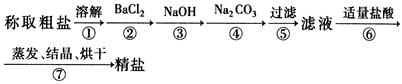 |
(1)判断BaCl2已过量的方法是 。
(2)第④步中,相关的离子方程式是 。
 (3)若先用盐酸调pH值再过滤,将对实验结果产生影响,其原因是 。
(3)若先用盐酸调pH值再过滤,将对实验结果产生影响,其原因是 。
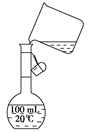
(4)为检验精盐纯度,需配制150 mL
0.2 mol/LNaCl(精盐)溶液,
右图是该同学转移溶液的示意图,
图中的错误是 。
(1)取第②步后的上层清液1~2滴于点滴板上,再滴入1~2滴BaCl2溶液,若溶液未变浑浊,则表明BaCl2已过量




 (2)Ca2++CO
(2)Ca2++CO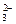 CaCO3↓
CaCO3↓
 Ba2++CO
Ba2++CO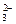 BaCO3↓
BaCO3↓
(3)在此酸性条件下,会有部分沉淀溶解,从而影响制得精盐的纯度
(4)未用玻璃棒引流;未采用150 mL容量瓶
(1)鉴别SO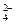 的特征试剂为含Ba2+的溶液,可取②步的上层清液再加BaCl2,看是否还产生沉淀来判断,若没有白色沉淀产生,则证明BaCl2已过量。
的特征试剂为含Ba2+的溶液,可取②步的上层清液再加BaCl2,看是否还产生沉淀来判断,若没有白色沉淀产生,则证明BaCl2已过量。
 (2)第④步的目的是为了除去Ca2+和过量的Ba2+,因此离子方程式应有Ca2++CO
(2)第④步的目的是为了除去Ca2+和过量的Ba2+,因此离子方程式应有Ca2++CO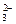
 CaCO3↓,Ba2++CO
CaCO3↓,Ba2++CO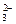 BaCO3↓。
BaCO3↓。
(3)如果先加盐酸调pH值再过滤,可能使部分沉淀溶解,导致所得食盐不纯。
(4)配制一定物质的量浓度溶液时,要求所选容量瓶的容积应与待配制溶液的体积相等,即150 mL容量瓶;转移溶液时应用玻璃棒引流,而图中所示没有按要求做。
