(14分)(Ⅰ)混合物的分离与提纯在化学实验中占有重要的位置。下图表示从固体混合物中分离X的方案,请回答有关问题。
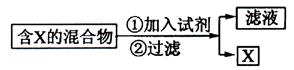
 (1)
(1)
若按照以上图示从某金属粉末(含有Au、Ag和Cu)中分离Au,加入的试剂是 ,有关反应的化学方程式为 ;
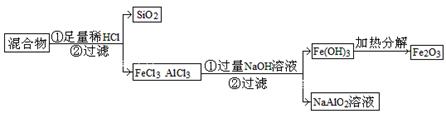
 (2)为提纯某Fe2O3样品(主要杂质有SiO2、A12O3),请设计一种以框图形式表示的实验方案(注明物质和操作) 。
(2)为提纯某Fe2O3样品(主要杂质有SiO2、A12O3),请设计一种以框图形式表示的实验方案(注明物质和操作) 。
(Ⅱ)工业上以黄铜矿为原料,采用火法熔炼工艺生产铜。
(1)该工艺的中间过程会发生反应: ,反应的氧化剂是______________,氧化产物为__________
,反应的氧化剂是______________,氧化产物为__________
(2)在精炼铜的过程中,电解液中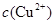 逐渐下降,
逐渐下降,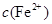 、
、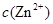 会逐渐增加,所以需定时除去其中的
会逐渐增加,所以需定时除去其中的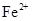 、
、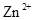 。下表为几种物质的溶度积。
。下表为几种物质的溶度积。
| 物质 |  | 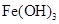 | 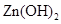 | 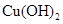 |
溶度积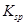 | 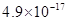 | 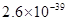 | 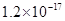 | 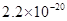 |

①试剂a是__________,其目的是____________________________________;根据溶度积该方案能够除去的杂质金属阳离子是____________。写出检验该杂质金属阳离子的操作方法:____________________________________________________________________________.
②乙同学在查阅资料时发现,“工业原料氯化铵中含杂质氯化铁,使其溶入水,再加入氨水
调节pH至7~8,可使 生成
生成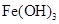 。沉淀而除去。”乙同学认为甲同学的方案中也
。沉淀而除去。”乙同学认为甲同学的方案中也
应该将溶液pH调至7~8。你认为乙同学的建议是否正确?________(填“是”或“否”),
理由是________________________________________________________________________。
(Ⅰ)(1)浓硝酸,Ag+2HNO3(浓) = AgNO3 + NO2↑+ H2O;
Cu + 4 HNO3(浓) = Cu(NO3)2 + 2NO2↑+2 H2O
(2)
(Ⅱ)(1)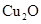 ,
,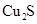 SO2(2)①
SO2(2)①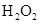 将
将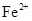 氧化成
氧化成
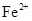 先加入KSCN溶液,若溶液不变红,再滴入几滴氯水(或硝酸),若溶液变成红色,说明含有该离子。 ②否 根据溶度积,当溶液pH为7~8时,溶液A中
先加入KSCN溶液,若溶液不变红,再滴入几滴氯水(或硝酸),若溶液变成红色,说明含有该离子。 ②否 根据溶度积,当溶液pH为7~8时,溶液A中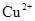 同时生成沉淀而被除去。
同时生成沉淀而被除去。
(Ⅰ)(1)金、银、铜三种金属中金的金属性最差,只有它不能与硝酸反应,故可选用硝酸作为试剂,过滤即可。
(2)三种氧化物中,SiO2、Al2O3都能与强碱溶液发生反应,但Fe2O3不能,故可以选浓NaOH溶液,反应后过滤。但如果SiO2的含量大,则不宜用前面所述的方法,可选用盐酸溶解,过滤后去除SiO2,再在混合液中加入过量NaOH溶液,过滤得Fe(OH)3沉淀,洗涤后加热,可得Fe2O3。
(Ⅱ)(1)分析化学方程式中元素的化合价的变化,可得出答案。
(2)①加入氧化剂,将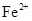 氧化成
氧化成 ,再利用氢氧化铁的溶度积较小,通过进行调节溶液的PH,氢氧化铁易先沉淀析出,,达到除去Fe2+ 的目的。②先加入KSCN溶液,若溶液不变红,再滴入几滴氯水(或硝酸),若溶液变成红色,说明含有该金属阳离子。
,再利用氢氧化铁的溶度积较小,通过进行调节溶液的PH,氢氧化铁易先沉淀析出,,达到除去Fe2+ 的目的。②先加入KSCN溶液,若溶液不变红,再滴入几滴氯水(或硝酸),若溶液变成红色,说明含有该金属阳离子。
③在调节溶液的PH时,要达到除去Fe2+但不能让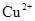 同时生成沉淀而被除去的效果。
同时生成沉淀而被除去的效果。
