某研究性学习小组,用下列仪器、药品验证合金(由Cu、Fe、Zn三种物质组成)和适量浓硝酸反应产生的气体中含NO(:NO2 21℃;-NO-152℃)
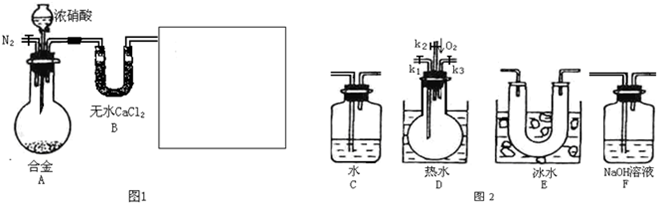
(1)在图2中选择恰当的仪器将图1补充完整,所选择仪器的连接顺序(按左→右连接,填各仪器编号)为______
(2)反应前先通入N2目的是______
(3)确认气体中含NO的现象是______
(4)如果O2过量,则装置F中发生反应的化学方程式为:______
(5)反应结束后,关闭开关将烧瓶拿出后的现象为______给出合理的解释______
(6)本题中,浓硝酸(含溶质amol)完全反应,还原产物只有NO和NO2,被还原硝酸的物质的量n的取值范围为______.
(1)因属与浓硝酸反应会生成二氧化氮,要验证NO的生成,则先冷却使二氧化氮与NO分离,则选择E装置,验证NO的存在,利用其与氧气反应生成红棕色气体,则选择D装置,
氮的氧化物对环境有污染,不能排放在环境中,应利用碱处理尾气,则选择F装置,所选择仪器的连接顺序为E→D→F,故答案为:E→D→F;
(2)因NO易被氧化,若装置中存在氧气则不能说明NO的存在,所以反应前先通入N2目的是排尽装置中的空气,防止NO被氧化,故答案为:排尽装置中的空气,防止NO被氧化;
(3)因NO与氧气反应生成二氧化氮,则观察到D中烧瓶内通入O2后,无色气体变成红棕色,
故答案为:D中烧瓶内通入O2后,无色气体变成红棕色;
(4)因氧气过量发生4NO2+O2+2H2O=4HNO3,硝酸与碱反应生成硝酸钠,整个过程的化学反应为4NO2+O2+4NaOH=4NaNO3,
故答案为:4NO2+O2+4NaOH=4NaNO3;
(5)2NO2⇌N2O4 △H<0,则将烧瓶拿出后,气体温度降低,平衡2NO2⇌N2O4 △H<0向右移动,NO2的浓度减小,气体颜色变浅,
故答案为:气体颜色变浅;烧瓶拿出后,气体温度降低,平衡2NO2⇌N2O4 △H<0向右移动,NO2的浓度减小,气体颜色变浅;
(6)由M+4HNO3═M(NO3)2+NO2↑+2H2O,只生成二氧化氮时,被还原硝酸的物质的量n为
mol,a 2
由3M+8HNO3═3M(NO3)2+2NO↑+4H2O,只生成一氧化氮,被还原硝酸的物质的量n为
mol,a 4
以上两个反应都发生,则被还原硝酸的物质的量
mol<n<a 4
mol,故答案为:a 2
mol<n<a 4
mol.a 2
