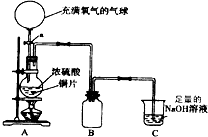
某中学高一课外兴趣小组为探究铜跟硫酸的反应情况,设计了如图所示装置进行有关实验.
(1)先关闭活塞a,将6.4g铜片和12mL某浓度的浓硫酸放在圆底烧瓶中共热至反应完毕,发现烧瓶中还有铜片剩余.再打开活塞a,将气球中的氧气缓缓挤入圆底烧瓶,最后铜片完全消失.
写出上述过程中烧瓶内发生的化学方程式:
关闭活塞a______;
打开活塞a______;
(2)该小组甲同学对“如何检验SO2中混有少许CO2”这个问题很感兴趣,他将A中铜片换作木炭粉,并在A、B之间连接了如下装置:
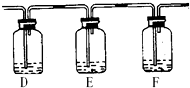
试剂:a.NaOH溶液 b.品红溶液 c.酸性KMnO4溶液 d.Ca(OH)2溶液
请回答:
①该同学的实验装置A中发生的化学方程式:______.
②若要达到此目的,可以在:(填所提供试剂编号)
D中加入______;E中加入______;F中加入______.
(3)事实证实,第(1)问铜片完全消失后,硫酸仍有剩余,乙同学欲测定余酸的物质的量浓度,假设反应前后溶液体积变化忽略不计,他向反应后溶液中加入含溶质a mol的NaOH溶液刚好使溶液中Cu2+全部沉淀.据此,他能求出余酸的物质的量浓度吗?若能,请写出余酸物质的量浓度的表达式:______mol/L(用含a的代数式表达,若不能,该空不填).
(1)浓硫酸具有强氧化性,在加热时可以氧化单质铜,生成硫酸铜、二氧化硫和水,方程式为2H2SO4(浓)+Cu
CuSO4+2H2O+2SO2↑;铜与浓硫酸反应是一个进程反应,随着反应进行,硫酸浓度降低,稀硫酸与铜不反应,在通入氧气的条件下能继续与铜反应,反应方程式为,2Cu+O2+2H2SO4 加热 .
2CuSO4+2H2O 加热 .
(或分步写成:2Cu+O2=2CuO;CuO+H2SO4=CuSO4+H2O也可);
故答案为:Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O;2Cu+O2+2H2SO4 加热 .
2CuSO4+2H2O(或分步写成:2Cu+O2=2CuO;CuO+H2SO4=CuSO4+H2O也可); 加热 .
(2)①浓硫酸在加热调价下与C反应生成SO2和CO2,反应的方程式为C+2H2SO4(浓)
CO2↑+2SO2↑+2H2O, 加热 .
故答案为:C+2H2SO4(浓)
CO2↑+2SO2↑+2H2O; 加热 .
②检验SO2中混有少许CO2,根据SO2的具有还原性,先将混合气体通入酸性高锰酸钾溶液,在用品红检验SO2是否除尽,最后通入澄清石灰水观察溶液是否变浑浊,
故答案为:c;b;d;
(3)n(Cu)=
=0.1mol,6.4g 64g/mol
则n(CuSO4)=0.1mol,
设反应后的溶液中含有xmolH2SO4,
则:H2SO4+2NaOH=Na2SO4+2H2O
1 2
x 2x
CuSO4+2NaOH=Na2SO4+Cu(OH)2↓
1 2
0.1mol 0.2mol
则有:2x+0.2=a
x=a-0.2 2
所以:反应后余酸的物质的量浓度为:
=
mola-0.2 2 0.012L
mol/L,125(a-0.2) 3
故答案为:能,
.125(a-0.2) 3
