校办厂漂白车间需22.4L(标准状况)SO2.化学小组同学依据化学方程式Zn+2H2SO4(浓)
ZnSO4+SO2↑+2H2O计算后,取65.0g锌粒与98%的浓H2SO4(ρ=1.84g/cm3)110mL充分反应,锌全部溶解后,即将收集所得气体如数送至车间,不料经质检科检验存在严重质量问题,气体随即被退回. △ .
(1)化学小组所制得的气体中混有的主要杂质气体可能是______(填分子式).产生这种结果的主要原因是______.
(2)为证实相关分析,化学小组的同学设计了如下实验,对退回气体(X)取样进行认真探究(遇有气体吸收过程,视为全吸收).
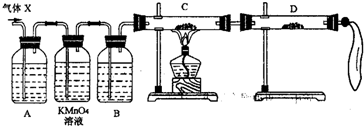
①组装好仪器后,盛放药品前,必要的一个操作是______.
②A中加入的试剂可能是:______,作用是:______.B中加入的试剂可能是:______,作用是:______.
③可证实气体X中混有较多量某杂质气体的实验现象是______.
(3)对上述装置略加改进,可粗略测定X气体中SO2的体积分数.改进时可选用的下列仪器为______(填代号).
A 导管 B 水槽 C 广口瓶 D 容量瓶 E 量筒 F 单孔塞 G 双孔塞.
(1)随着反应的进行,硫酸浓度降低,锌与稀硫酸反应生成硫酸锌和H2,反应为:Zn+H2SO4═ZnSO4+H2↑,
因此化学小组所制得的气体中混有的主要杂质气体可能是氢气,故答案为:H2;
(2)①探究退回气体(X)的成分,一旦漏气.无法探究,故答案为:检查装置气密性;
②因二氧化硫漂白原理在于能与有机色素结合成无色的不稳定化合物,所以A中加入的试剂可能是品红试液,作用是确认SO2存在;浓硫酸具有吸水性,吸水,具有干燥作用,防止混杂的水对装置D中的现象产生干扰;
故答案为:品红试液;确认SO2存在; 浓H2SO4;干燥氢气;
③根据题目给出的装置图和反应原理知:装高锰酸钾的装置是检验二氧化硫是否除尽的装置,B是浓硫酸,吸水干燥作用;C是用还原性气体还原氧化铜的装置,D中盛放的是无水硫酸铜,检验是否有水生成,只要黑色变红色,无水硫酸铜变蓝色,就证明是氢气,故答案为:黑色CuO粉末变红色,无水硫酸铜变蓝色;
(3)根据题目给出的装置图和反应原理知:经过C后,只有氢气,氢气不溶于水,用排水法收集,所以应该是从短管进长管出,排出水的体积就是氢气体积,故答案为:CEG;
