已知某种治疗胃病药品的主要成份是铝碳酸镁片,化学式为AlaMgb(OH)16CO3·4H2O,假设药品中的其它成份受热不分解、不溶于水且不与稀硫酸反应。某研究性学习小组设计了如下实验探究铝碳酸镁片的组成。
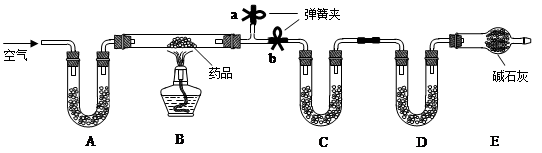
【实验一】取m g该药片,研成粉末放入硬质玻璃管中,加热,充分反应后测得装置C增重2.16g,装置D增重0.44g。
(1)铝碳酸镁片加热分解的产物为Al2O3、MgO、CO2和水,则为分别测定CO2和水的质量,装置C和D中盛放的药品应选择:C D (填序号)。
①浓硫酸 ②碱石灰 ③氯化钙 ④纯碱
(2)实验开始前先通入一定量空气,其操作方法是关闭弹簧夹 ,打开弹簧夹 ,目的是 。
(3)一段时间后,打开弹簧夹 ,关闭弹簧夹 ,点燃酒精灯加热,充分反应后,停止加热,继续通入空气至玻璃管冷却的目的是 (填序号)。
①排净空气防爆炸
②防止空气中水和二氧化碳进入C、D影响测定
③使生成水和二氧化碳进入C、D被充分吸收
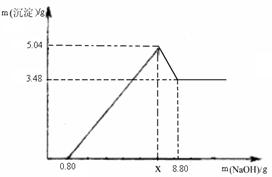
【实验二】另取m g该药片,加入100 g 9.8%的稀硫酸,充分反应后滤去不溶物,得到含有MgSO4和Al2(SO4)3等溶质的滤液,向滤液中逐渐加入足量的稀NaOH溶液,产生沉淀的物质的质量与加入NaOH质量的关系如图。
已知:MgSO4+2NaOH=Mg(OH)2↓+Na2SO4
Al2(SO4)3+6NaOH=2Al(OH)3↓+3Na2SO4
Al(OH)3+NaOH=NaAlO2+2H2O,
Mg(OH)2不溶于NaOH, NaAlO2可溶于水。
(1)图中NaOH加入0.80g,仍没有沉淀,说明滤液中含 。当加入NaOH的质量到x时,生成的沉淀有 和 ,其中Al(OH)3的质量是 g,则x= g。
(2)有医生建议患有严重胃溃疡的患者最好慎用该药,试用你所学的知识解释这样建议的理由是 。
(3)试确定铝碳酸镁的化学式为 。
【实验一】(1)③ ②
(2)b a 排尽装置内空气,防止干扰
(3)b a ③
【实验二】(1)稀硫酸 Al(OH)3 Mg(OH)2 1.56 4
(2)该药在使用过程中会产生气体,严重胃溃疡的患者服用会产生胃穿孔
(3)Al2Mg6(OH)16CO3·4H2O
题目分析:【实验一】(1)C中应装的是固体干燥剂所以选③,D中药品作用是吸收二氧化碳,所以选②。
(2)验开始前先通入一定量空气,其操作方法是关闭弹簧夹b,然后打开a ,将多余的空气排出,防止空气对实验形成干扰。
(3)一段时间后,打开弹簧夹空气排尽后应关闭a ,打开b ,继续通入空气至玻璃管冷却的目的是使生成水和二氧化碳进入C、D被充分吸收。
【实验二】(1)图中NaOH加入0.80g,仍没有沉淀,说明滤液中含稀硫酸,NaOH先和稀硫酸反应,没有产生沉淀,后来才与MgSO4,Al2(SO4)3反应生成Al(OH)3 和 Mg(OH)2。由题意知道Al(OH)3还能和NaOH反应,所以图中沉淀质量会减少,减少的质量即为Al(OH)3 的质量,5.04 – 3.48 = 1.56g,最后剩余的沉淀即为Mg(OH)2沉淀,为3.48g。在0.8到x这段发生的反应为MgSO4+2NaOH = Mg(OH)2 ↓+ Na2SO4 Al2(SO4)3 + 6NaOH = 2Al(OH)3 ↓+3 Na2SO4,根据生成的Mg(OH)2和Al(OH)3的质量可以求出NaOH的总质量为7.2g,则x为0.8+7.2 = 8g。
(2)该药在使用过程中会产生气体,严重胃溃疡的患者服用会产生胃穿孔
(3)由(1)可求出物质中镁元素与铝元素的质量比为48:9 =" 24b" :27a ,则a:b=1:3,再根据正负化合价代数和为0,可求出此物质的化学式为Al2Mg6(OH)16CO3·4H2O
