某实验小组同学为了探究铜与浓硫酸的反应,进行了如下实验,实验装置如下所示.实验步骤及现象如下:①先连接如图装置,检查气密性,再加入试剂;②加热试管A,B中品红溶液退色,熄灭酒精灯;③将Cu丝向上抽动使下端离开液面.
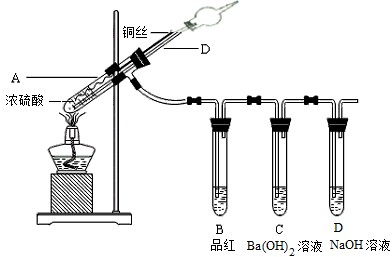
(1)步骤(2)中试管A中物质发生反应的化学方程式______.
(2)在盛有BaCl2溶液的试管C中,除了导管口有气泡外,无其他明显现象,将试管中的溶液取出,滴加氯水,产生的现象是______;发生反应的离子方程式为______,______.
(3)试管D中NaOH溶液的作用是______.
(4)试管B中品红溶液退色说明SO2具有漂白性,已知Cl2也能使品红退色.现有两瓶分别经过SO2和Cl2漂白过的品红溶液,请你设计一个简单的实验对其进行鉴别(写明操作方法、现象及结论)______.
(1)铜与浓硫酸共热生成硫酸铜、二氧化硫和水,反应方程式为:Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O,△ .
故答案为:Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O;△ .
(2)氯气能够与二氧化硫发生氧化还原反应生成硫酸根离子,硫酸根离子与钡离子反应生成硫酸钡沉淀,反应的离子方程式为:SO2+H2O+Cl2═2Cl-+4H++SO42-、SO42-+Ba2+=BaSO4↓,所以向试管中滴加氯水,溶液会变浑浊,
故答案为:溶液变浑浊;SO2+H2O+Cl2═2Cl-+4H++SO42-;SO42-+Ba2+=BaSO4↓;
(3)二氧化硫有毒,为了防止造成污染,需要使用尾气吸收装置,可以用氢氧化钠溶液吸收多余的二氧化硫,
故答案为:吸收SO2防止污染;
(4)因二氧化硫的漂白为暂时性,结合生成的无色物质不稳定,则实验方案为将褪色后的溶液加热,若重新恢复红色,则通入的气体是SO2;若仍为无色,则通入的气体是Cl2,
故答案为:将褪色后的溶液加热,若重新恢复红色,则通入的气体是SO2;若仍为无色,则通入的气体是Cl2.
