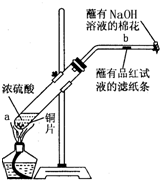
某学生做浓硫酸性质的实验:
在一支试管中放入一块很小的铜片,再加入2mL浓硫酸,然后把试管固定在铁架台上.把一小条蘸有品红溶液的滤纸放入带有单孔橡皮塞的玻璃管中.塞紧试管口,在玻璃管口处缠放一团蘸有NaOH溶液的棉花.加热试管,观察现象.
回答下列问题:
(1)写出试管中发生反应的化学方程式______.
(2)试管中的液体反应一段时间后,b处滤纸条的变化为______,待试管中反应停止后,给玻璃管放有蘸过品红溶液的滤纸处微微加热,滤纸条的变化为______.
(3)蘸有NaOH溶液的棉花团作用是______.
(4)硫酸型酸雨的形成过程可用下列反应中的______来表示.
A.2SO2+O2
2SO3催化剂
B.SO3+H2O═H2SO4
C.SO2+H2O2═H2SO4.
(1)铜和浓硫酸在加热条件下能发生反应,浓硫酸具有强氧化性,被铜还原为二氧化硫,所以产物有生成的硫酸铜、二氧化硫和水;书写化学方程式为Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O; △ .
故答案为:Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O △ .
(2)二氧化硫能和有色物质生成无色物质,二氧化硫能使品红溶液褪色,所以二氧化硫具有漂白性;但生成的无色物质不稳定,加热时会恢复原来的颜色.
故答案为:品红溶液褪色;溶液恢复红色;
(3)二氧化硫有毒,所以不能直接排空,二氧化硫是酸性氧化物,能和碱反应生成盐和水,所以试管Ⅱ管口塞一团浸有
NaOH溶液的棉花的作用是吸收未反应的SO2气体,发生反应的离子方程式为SO2+2OH-=SO32-+H2O;
故答案为:吸收未反应的SO2气体,防止污染空气;
(4)硫酸型酸雨的形成过程,利用浮尘等催化作用下把二氧化硫氧化为三氧化硫,溶于水形成硫酸;所以AB反应符合;
故答案为:AB;

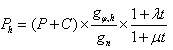 来计算本站气压,其中
来计算本站气压,其中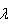 为()。
为()。