甲乙丙丁四位同学同时做完了H2、CO、CH4在空气里燃烧的实验后,有下列认识,其中正确的是( )
A.甲认为:一种物质发生反应后,如果有水生成,则该物质中一定含有氢元素
B.丙认为:一种物质在空气里燃烧,若能产生水,则该物质中一定含有氢元素
C.乙认为:由于H2、CO、CH4均能在空气里燃烧,故它们在与空气混合后都有可能形成爆鸣气,所以在点燃前必须先检验其纯度
D.丁认为:从环境保护的角度考虑,大量使用H2、CO、CH4作气体燃料时,若气体完全燃烧,则对环境影响最大的是CO
A、一种物质发生反应后,因不知道反应物有几种,所以如果有水生成,根据质量守恒定律可知,该物质中不一定含有氢元素,故A说法错误;
B、一种物质在空气里燃烧,若能产生水,因氧气中不含氢元素,根据质量守恒定律可知,该物质中一定含有氢元素,故B说法正确;
C、三种气体都是可燃性的气体,如果不纯,在爆炸极限范围内,点燃都会发生爆炸,所以需要验纯,故C说法正确;
D、氢气燃烧生成水不会污染环境,从化学方程式2CO+O2
2CO2、CH4 +2O2 点燃 .
CO2 +2H2O看等质量的一氧化碳和甲烷完全燃烧,甲烷需要的氧气多,生成的二氧化碳多,因此对环境影响最大的是甲烷,故D说法错误.点燃 .
故选BC.

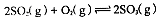 ,反应混合体系SO3的百分含量和温度的关系如图所示(曲线上任何一点都表示平衡状态),根据图示回答下列问题:
,反应混合体系SO3的百分含量和温度的关系如图所示(曲线上任何一点都表示平衡状态),根据图示回答下列问题: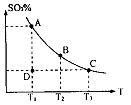
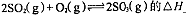 0(填“>”或“<”)。若在恒温恒容条件下,上述反应达到平衡,再给该平衡体系中通入SO3气体,容器内的压强 (填“增大”、“减小”或“不变”),平衡 移动(填“向正反应方何”、“逆反应方向’或“不”)若在恒温恒压条件下,上述反应达到平衡,再给该平衡体系中通人大量氮气后,体系重新达到平衡,此平衡与原平衡相比较,SO2的物质的量 __(填“增大”、“减小”或“不变”),O2的物质的量浓度 (填“增大”、“减小”或“不变”)。
0(填“>”或“<”)。若在恒温恒容条件下,上述反应达到平衡,再给该平衡体系中通入SO3气体,容器内的压强 (填“增大”、“减小”或“不变”),平衡 移动(填“向正反应方何”、“逆反应方向’或“不”)若在恒温恒压条件下,上述反应达到平衡,再给该平衡体系中通人大量氮气后,体系重新达到平衡,此平衡与原平衡相比较,SO2的物质的量 __(填“增大”、“减小”或“不变”),O2的物质的量浓度 (填“增大”、“减小”或“不变”)。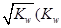 是水的离子积),则这两种溶液可为 (填字母)。
是水的离子积),则这两种溶液可为 (填字母)。