化学兴趣小组为探究铁与浓硫酸反应,设计了如下图所示装置进行实验,回答相关问题.
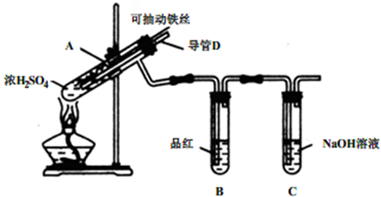
(1)用“可抽动的铁丝”代替“直接投入铁片”的优点是:______.
(2)能说明有SO2气体产生的实验现象是______.
(3)反应后,不需要打开胶塞,就可使装置中残留气体完全被吸收,应当采取的操作是______.
(4)反应一段时间后,他们对A中溶液的金属离子进行探究,请完成相关问题.
①提出假设:
假设1:只含有Fe3+;
假设2:______;
假设3:既有Fe2+,又有Fe3+.
②设计实验方案验证假设3.在答题卡上写出实验步骤、预期现象和结论.
限选试剂及仪器:稀硫酸、KMnO4溶液、NaOH溶液、淀粉-KI溶液、H2O2溶液
| 实验步骤 | 预期现象和结论 |
| 步骤一:用胶头滴管取A试管中的溶液,用水稀释并分装试管I、II备用 | ______ |
| 步骤二:往试管I中,______ | ______ |
| 步骤三:______ | ______ |
(1)在加热的条件下,当铁丝与浓硫酸接触时才能反应,当往上抽动铁丝时,铁丝与硫酸不接触,反应停止,所以用“可抽动的铁丝”的优点是便于控制反应的反应,故答案为:便于控制反应的反应和停止;
(2)SO2具有漂白性,品红能被二氧化硫漂白,可用品红溶液验证SO2的生成,所以能说明有SO2气体产生的实验现象是品红溶液褪色,故答案为:品红溶液褪色;
(3)从D管口向装置A中大量鼓气,就可使装置中残留气体完全被吹出,气体被赶到从装置BC中通过,经过B时,二氧化硫被吸收,经过C时已经完全吸收,故答案为:从D管口向A中大量鼓气;
(4)①铁与浓硫酸反应,铁可能被氧化成Fe3+或Fe2+;对A中溶液的金属离子,可能有:只含有Fe3+;只含有Fe2+;
既有Fe2+,又有Fe3+,三种情况,故答案为:只含有Fe2+;
②设计实验方案验证假设3:须验证Fe3+和Fe2+,步骤一:用胶头滴管取A试管中的溶液,用水稀释并分装试管I、II备用,二价铁离子浅绿色,三价铁离子棕黄色,所以预期现象和结论是溶液有颜色;步骤二:往试管I中,滴加少量的淀粉KI溶液,若溶液变蓝色,Fe3+能氧化碘离子,把碘离子氧化成单质碘,单质碘与淀粉作用显蓝色,则说明原溶液中含有 Fe3+;步骤三:往试管II滴加到少量的 KMnO4溶液,Fe2+能还原高锰酸根离子,若溶液褪色,则说明原溶液中含有 Fe2+,结合步骤二溶液变蓝,则假设3正确,故答案为:
| 实验步骤 | 预期现象和结论 |
| 步骤二:滴加少量的淀粉KI溶液 | 若溶液变蓝色,则原溶液中含有 Fe3+ |
| 步骤三:往试管II滴加到少量的 KMnO4溶液 | 若溶液褪色(浅红),则原溶液中含有 Fe2+,结合步骤二溶液变蓝,则假设3正确 |
