有一种工业废水,含有大量的ZnSO4和少量CuSO4以及污泥。兴趣小组的同学想从中回收金属铜和硫酸锌晶体,他们设计了如下方案:
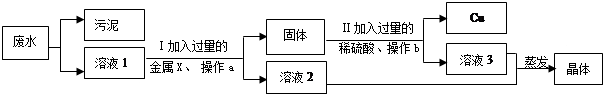
(1)操作a、b的名称是 ,其目的是除去溶液中 。步骤Ⅱ中发生反应的化学方程式为 。
(2)甲同学提出X可用金属铁,乙同学认为X可用金属锌,你认为 (填“甲”或“乙”)同学的意见是正确的,理由是 。步骤Ⅰ中加入过量的金属X的目的是 。
(3)若溶液1和溶液2中溶质ZnSO4的质量分数分别表示为a、b,则a、b的大小关系是__________;溶液3中的溶质是 (填化学式)。
(1)过滤 难溶性固体 H2SO4 + Zn →H2↑+ ZnSO4
(2)乙 金属铁会与硫酸反应生成FeSO4引入新的杂质 保证将溶液里CuSO4中Cu完全置换出来
(3)a < b ZnSO4 和H2SO4
题目分析:此题属于框图式兼叙述型的物质制备题,解题时应根据已知物质和所需要得到的物质,找寻它们之间的特点,再结合实验过程加以分析,此题工业废水,含有大量的ZnSO4和少量CuSO4以及污泥从中回收金属铜和硫酸锌晶体,所以步骤Ⅰ加入过量的金属x应是锌,经过滤后,得到的固体既有反应生成的铜,也有过量的锌,所以步骤Ⅱ加入过量的稀硫酸,是固体中的锌与稀硫酸反应,
(1)过滤是将不溶性固体与液体分离的方法,故操作a、b的名称是:过滤,其目的是除去溶液中难溶性固体,步骤Ⅱ中发生反应的化学方程式为:H2SO4 + Zn →H2↑+ ZnSO4
(2)乙同学同学的意见是正确的,理由是:金属铁会与硫酸反应生成FeSO4引入新的杂质,步骤Ⅰ中加入过量的金属X的目的是:保证将溶液里CuSO4中Cu完全置换出来
(3)溶液1只发生了一个反应:CuSO4 + Zn →Cu+ ZnSO4,生成了ZnSO4,得到溶液2,溶液1和溶液2中溶质ZnSO4的质量分数分别表示为a、b,则a、b的大小关系是:a < b,溶液3中的溶质是:除了原溶液中的ZnSO4,还有过量的硫酸,所以溶液3中的溶质是:ZnSO4 和H2SO4
