对比学习有利于发现事物的共性与个性。为探究酸的化学性质,同学们进行了如下实验。
| 实验内容 | 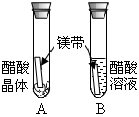 | 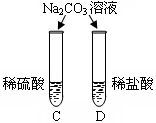 | 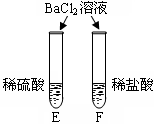 |
| 实验现象 | A试管内无明显现象,B试管中镁带表面观察到的现象是 。 | C、D两试管中均观察到有气泡产生。 | E试管中观察到的现象是 ; F试管中无明显现象。 |
| 结论 | 酸的很多反应通常在水溶液中才能完成。 | 不同的酸具有相似的化学性质。 | 不同的酸根会导致酸的“个性”有差异。 |
请分析上述现象并回答:
(1)不同的酸具有相似的化学性质,这是因为酸的组成中都含有 (填元素符号)。
(2)不同的酸根会导致酸的“个性”有差异,因此,可用 鉴别盐酸和硫酸。
(3)清洗试管时,将C、F两试管中的无色液体同时倒入一个洁净的废液缸,废液缸中立刻冒气泡并出现白色沉淀。废液缸里最终产生的白色沉淀中一定含有硫酸钡,该反应的化学方程式为 ,白色沉淀中可能还含有 (填化学式)。
有气泡产生或冒气泡 白色沉淀产生
(1)H(H+)
(2)氯化钡(氢氧化钡、硝酸钡、可溶性钡盐)
(3)Na2SO4+BaCl2→2NaCl +BaSO4↓ BaCO3
题目分析:醋酸属于酸,溶液中有氢离子,所以能与活泼金属反应,产生氢气,所以B试管中镁带表面观察到的现象是:有气泡产生或冒气泡;把BaCl2溶液滴加到稀硫酸中,发生反H2SO4+BaCl2=BaSO4↓+2HCl,有白色沉淀BaSO4生成
(1)不同的酸具有相似的化学性质,这是因为酸的组成中都含有H+
(2)不同的酸根会导致酸的“个性”有差异,硫酸中含有硫酸根,而盐酸不含有,所以可用氢氧化钡、氯化钡(可溶性钡盐)来鉴别盐酸和硫酸
(3)F试管中的无色液体含BaCl2和HCl,而C试管中的无色液体含的溶质有三种情况:1、只含Na2SO4,2、含Na2SO4和Na2CO3,3、含Na2SO4和H2SO4,将C、F两试管中的无色液体同时倒入一个洁净的废液缸,废液缸中立刻冒气泡,说明C试管中的无色液体含的溶质Na2SO4和Na2CO3,所以废液缸里最终产生的白色沉淀中一定含有硫酸钡,该反应的化学方程式为:Na2SO4+BaCl2→2NaCl +BaSO4↓,当然还可能发生反应:Na2CO3+BaCl2=BaCO3↓+2NaCl,所以白色沉淀中可能还含有BaCO3
