将V1mL3.65% HCl溶液逐滴滴入盛有V2mL未知浓度的
NaOH溶液的烧杯中(图1),测量并记录溶液的pH变化(图2)和
温度变化(图3)。(实验中始终保持 V1+V2=50.0mL且各种溶液密度
均为1.0g/mL)。



(1)图2中V1="0" mL时,图1中烧杯内溶液的颜色显 色;
(2)实验中发生反应的化学方程式为 ;
(3)图2中的pH=7时,此时滴入的HCl溶液的体积V1= mL;
(4)通过该实验给出的判断,其中正确的是 ;
A.进行该实验时环境温度为22℃
B.该实验表明化学能可转化为热能
C.该实验表明有水生成的反应都是放热反应
D.溶液由碱性转变为中性,再转变为酸性且酸性不断减弱(5)实验中所用NaOH溶液的溶质质量分数为 。
(1)红; (2)HCl+NaOH═NaCl+H2O; (3)30 ; (4)B ; (5)6.0%
题目分析:(1)图2中V1=0mL时,图1中烧杯内溶液显碱性,碱能使酚酞变红;(2)实验中发生反应为:HCl与NaOH生成NaCl和H2O;(3)由图3中的信息可知,溶液温度最高时为酸碱恰好完全反应,溶液显中性pH=7,此时滴入的HCl溶液的体积V1=30ml;(4)A.进行该实验时环境温度为22℃,不正确,由图示3中信息可知V1=5mL时温度为22℃;B.该实验中温度升高,表明该化学反应放出热量,表明化学能可转化为热能;C.该化学反应生成了水,但不能代表只要生成水的反应都放热;D.该反应中溶液由碱性转变为中性,再转变为酸性且酸性不断增强;
(5)设,所用NaOH溶液的溶质质量为x,消耗盐酸溶液中溶质的质量为:30ml×1.0g/ml×3.65%=1.095g
HCl+NaOH═NaCl+H2O;
36.5 40
1.095g x
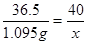 x=1.2g
x=1.2g
实验中所用NaOH溶液的溶质质量分数为: ×100%=6.0%
×100%=6.0%
