问题
问答题
根据如图所示的实验装置,回答下列问题:
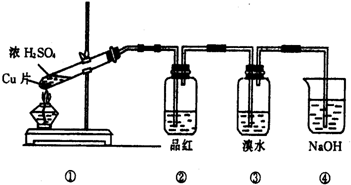
(1)写出铜与浓硫酸反应的化学方程式______
(2)证明SO2具有漂白性的现象是______,再加热该溶液,现象是______.
(3)装置③中的现象是______,证明SO2具有______.
(4)装置④的作用是______.
答案
(1)浓硫酸和铜在加热的条件下生成硫酸铜、二氧化硫和水,化学方程式为:Cu+2H2SO4(浓)
CuSO4+2H2O+SO2↑,△ .
故答案为:Cu+2H2SO4(浓)
CuSO4+2H2O+SO2↑;△ .
(2)SO2可以使品红溶液褪色,体现了SO2具有漂白性,SO2的漂白是暂时性的漂白,生成的物质不稳定,受热易分解,重新变为红色,
故答案为:褪色;又变为红色;
(3)二氧化硫具有较强的还原性,可与溴单质反应生成硫酸和氢溴酸,因此装置③中的现象为溶液褪色,
故答案为:褪色;还原性;
(4)二氧化硫污染空气,二氧化硫可以被氢氧化钠溶液吸收,减少空气污染,因此装置④的作用是:吸收多余的二氧化硫气体,防止污染空气,
故答案为:吸收多余的二氧化硫气体,防止污染空气.